2021年8月26日����,為加強(qiáng)醫(yī)療器械產(chǎn)品注冊(cè)工作的監(jiān)督和指導(dǎo),進(jìn)一步提高醫(yī)療器械注冊(cè)審查質(zhì)量�,國(guó)家藥品監(jiān)督管理局組織制定了《應(yīng)用納米材料的醫(yī)療器械安全性和有效性評(píng)價(jià)指導(dǎo)原則第一部分:體系框架》,詳見正文����。
2021年8月26日���,為加強(qiáng)醫(yī)療器械產(chǎn)品注冊(cè)工作的監(jiān)督和指導(dǎo),進(jìn)一步提高醫(yī)療器械注冊(cè)審查質(zhì)量��,國(guó)家藥品監(jiān)督管理局組織制定了《應(yīng)用納米材料的醫(yī)療器械安全性和有效性評(píng)價(jià)指導(dǎo)原則第一部分:體系框架》���,詳見正文����。

應(yīng)用納米材料的醫(yī)療器械安全性和有效性評(píng)價(jià)指導(dǎo)原則第一部分:體系框架
一�����、背景
現(xiàn)有的醫(yī)療器械中應(yīng)用的納米材料包括添加到醫(yī)療器械中的游離態(tài)納米材料��,利用納米材料特性增加生物學(xué)活性(如醫(yī)用納米羥基磷灰石/聚酰胺66復(fù)合骨充填材料)或者預(yù)防感染(如納米銀創(chuàng)傷貼)的固化納米材料以及利用納米技術(shù)設(shè)計(jì)制備成納米結(jié)構(gòu)的醫(yī)療器械(如口腔種植體材料表面納米化處理)等����。此外,即使醫(yī)療器械本身不含有納米材料���,其使用/植入過程也有可能導(dǎo)致納米顆粒的產(chǎn)生���。
根據(jù)國(guó)家標(biāo)準(zhǔn)(GB/T 30544.1)�����,納米材料是指任一外部維度�����、內(nèi)部或表面結(jié)構(gòu)處于納米尺度的材料���,而納米尺度是指1~100 nm之間的尺寸范圍,該尺寸范圍通常�����,但非專有地表現(xiàn)出不能由較大尺寸外推得到的特性�����,對(duì)于這些特性來說�,1-100 nm的上���、下限值是近似的����。納米材料獨(dú)特的物理、化學(xué)和生物學(xué)性質(zhì)為醫(yī)療器械獲得突破性發(fā)展提供了新的機(jī)遇���,同時(shí)也蘊(yùn)含潛在的臨床應(yīng)用風(fēng)險(xiǎn)����。
本指導(dǎo)原則為申請(qǐng)人/監(jiān)管人員提供關(guān)于應(yīng)用納米材料的醫(yī)療器械安全性和有效性評(píng)價(jià)相關(guān)方面的信息�����。
本指導(dǎo)原則是對(duì)應(yīng)用納米材料醫(yī)療器械的一般要求����,申請(qǐng)人應(yīng)依據(jù)具體產(chǎn)品的特性對(duì)注冊(cè)申報(bào)資料的內(nèi)容進(jìn)行充分說明和細(xì)化。申請(qǐng)人還應(yīng)依據(jù)具體產(chǎn)品的特性確定其中的具體內(nèi)容是否適用���,若不適用�,需詳細(xì)闡述理由及相應(yīng)的科學(xué)依據(jù)���。
本指導(dǎo)原則是對(duì)申請(qǐng)人和審評(píng)人員的指導(dǎo)性文件��,但不包括注冊(cè)審批所涉及的行政事項(xiàng)��,亦不作為法規(guī)強(qiáng)制執(zhí)行��,如果有能滿足相關(guān)法規(guī)要求的其它方法�,也可以采用,但是需要提供詳細(xì)的研究資料和驗(yàn)證資料����。應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制定的�����,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善��,以及科學(xué)技術(shù)的不斷發(fā)展���,本指導(dǎo)原則相關(guān)內(nèi)容也將進(jìn)行適時(shí)的調(diào)整�����。
二����、適用范圍
本指導(dǎo)原則適用于與人體直接或間接接觸�����,由納米材料組成或包含納米材料的醫(yī)療器械的安全性和有效性評(píng)價(jià)�����。
不適用于:
- 應(yīng)用納米材料的體外診斷(In Vitro Diagnosis�����,IVD)產(chǎn)品�����,但在考慮IVD產(chǎn)品有效性時(shí)��,可參考相關(guān)內(nèi)容�����;
- 應(yīng)用納米材料的賦能技術(shù)�����;
- 應(yīng)用納米材料的藥品���;
- 應(yīng)用納米材料的醫(yī)療器械在制造和廢棄過程中造成的職業(yè)和環(huán)境風(fēng)險(xiǎn)�。
三、一般原則
(一)應(yīng)用納米材料醫(yī)療器械的分類
目前現(xiàn)有或者正在處于研發(fā)階段的應(yīng)用納米材料的醫(yī)療器械���,按照GB/T 16886.1進(jìn)行分類���。對(duì)于所有類型的醫(yī)療器械,納米材料的潛在暴露均應(yīng)納入考慮��。
(二)風(fēng)險(xiǎn)評(píng)估
納米材料的特性為醫(yī)療器械獲得突破性發(fā)展提供了新機(jī)遇���,同時(shí)也存在潛在的不確定風(fēng)險(xiǎn)���,在設(shè)計(jì)、臨床前測(cè)試���、臨床評(píng)價(jià)和設(shè)計(jì)變更等階段���,注冊(cè)申請(qǐng)人可以根據(jù)GB/T 16886.1、YY/T 0316和《醫(yī)療器械產(chǎn)品受益-風(fēng)險(xiǎn)評(píng)估注冊(cè)技術(shù)審查指導(dǎo)原則》等中規(guī)定的風(fēng)險(xiǎn)因素�,對(duì)應(yīng)用納米材料的醫(yī)療器械進(jìn)行風(fēng)險(xiǎn)評(píng)估。應(yīng)用納米材料醫(yī)療器械的風(fēng)險(xiǎn)因素主要包括納米材料從器械釋放的可能性�、暴露劑量、暴露途徑�、接觸部位和暴露時(shí)間。
(三)安全性評(píng)價(jià)
生物學(xué)評(píng)價(jià)是應(yīng)用納米材料醫(yī)療器械安全性評(píng)價(jià)的重要內(nèi)容��。GB/T 16886.1規(guī)定了應(yīng)當(dāng)根據(jù)器械類型�����、接觸途徑和接觸時(shí)間來進(jìn)行生物學(xué)風(fēng)險(xiǎn)評(píng)估的程序框架�����,該程序框架通常也適用于應(yīng)用納米材料的醫(yī)療器械��。GB/T 16886系列標(biāo)準(zhǔn)的后續(xù)部分描述了詳細(xì)的試驗(yàn)方案和評(píng)價(jià)策略�����。
當(dāng)前ISO TC 194“醫(yī)療器械生物相容性評(píng)價(jià)技術(shù)委員會(huì)”已頒布了醫(yī)療器械生物學(xué)評(píng)價(jià)第22部分:納米材料指南�����,納米材料生物學(xué)評(píng)價(jià)可參考ISO/TR 10993-22�。目前,已發(fā)布并實(shí)施的三項(xiàng)推薦性標(biāo)準(zhǔn):YY/T 0993�、YY/T 1295和YY/T 1532���,這些標(biāo)準(zhǔn)為應(yīng)用納米材料的醫(yī)療器械生物學(xué)評(píng)價(jià)提供了專屬方法。
由于納米材料的比表面積等因素不同���,納米材料表現(xiàn)出不同的理化性質(zhì)��,因此���,生物體暴露于納米材料之后,可能表現(xiàn)出與常規(guī)材料不同的生物學(xué)反應(yīng)����。申請(qǐng)人應(yīng)針對(duì)醫(yī)療器械的結(jié)構(gòu)特征、預(yù)期用途�����、與人體的接觸途徑���、所含納米材料的種類和形態(tài)等因素���,通過設(shè)計(jì)一系列試驗(yàn)來確認(rèn)測(cè)試系統(tǒng)的適用性,從而建立起適合所申報(bào)產(chǎn)品特點(diǎn)的生物學(xué)評(píng)價(jià)試驗(yàn)方案。應(yīng)用納米材料醫(yī)療器械的安全性評(píng)價(jià)流程和路徑見圖1��。
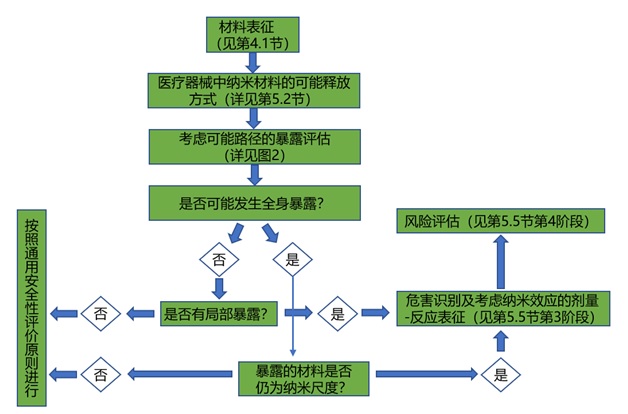
圖1 作為應(yīng)用納米材料醫(yī)療器械風(fēng)險(xiǎn)評(píng)估組成部分的安全性評(píng)價(jià)流程圖
(四)有效性評(píng)價(jià)
應(yīng)用納米材料的醫(yī)療器械有效性評(píng)價(jià)方法可包括臺(tái)架試驗(yàn)�����、體外測(cè)試�����、計(jì)算機(jī)模擬����、動(dòng)物實(shí)驗(yàn)和臨床試驗(yàn)����。申請(qǐng)人應(yīng)闡明在產(chǎn)品中使用納米材料/納米技術(shù)的必要性,以及與不采用納米材料的已上市同品種醫(yī)療器械明顯優(yōu)勢(shì)�。如有可能,臨床試驗(yàn)建議采用優(yōu)效性試驗(yàn)�����。
應(yīng)用納米材料的醫(yī)療器械開展動(dòng)物實(shí)驗(yàn)評(píng)價(jià)�����,可以根據(jù)醫(yī)療器械動(dòng)物實(shí)驗(yàn)研究技術(shù)審查指導(dǎo)原則第一部分和第二部分的要求進(jìn)行。臨床評(píng)價(jià)應(yīng)按照《醫(yī)療器械監(jiān)督管理?xiàng)l例》《醫(yī)療器械注冊(cè)管理辦法》《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》和《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》等要求進(jìn)行���。
由于納米技術(shù)是正在快速發(fā)展的新興領(lǐng)域���,應(yīng)用納米材料的醫(yī)療器械在進(jìn)行風(fēng)險(xiǎn)評(píng)估時(shí),可能無法與已上市的同品種醫(yī)療器械進(jìn)行等同性比較����,需要通過適宜的動(dòng)物模型和臨床試驗(yàn)來評(píng)價(jià)其有效性。申請(qǐng)人宜提出明確的試驗(yàn)?zāi)康模磾M解決的問題)����,并根據(jù)試驗(yàn)?zāi)康挠删哂邢鄳?yīng)專業(yè)知識(shí)和實(shí)踐經(jīng)驗(yàn)的人員來制定科學(xué)、合理的研究方案���。
(五)安全性和有效性評(píng)價(jià)體系框架
根據(jù)《醫(yī)療器械安全和性能的基本原則》����,醫(yī)療器械應(yīng)是安全的并且能夠?qū)崿F(xiàn)其預(yù)期性能�����,其設(shè)計(jì)和生產(chǎn)應(yīng)確保器械在預(yù)期使用條件下達(dá)到預(yù)期目的,與患者受益相比����,其風(fēng)險(xiǎn)應(yīng)是可接受的,且不會(huì)損害醫(yī)療環(huán)境�����、患者安全����、使用者及他人的安全和健康����。
本系列指導(dǎo)原則將在充分吸收最新科研成果的基礎(chǔ)上,分別對(duì)應(yīng)用納米材料的醫(yī)療器械理化表征�����、生物學(xué)評(píng)價(jià)���、動(dòng)物實(shí)驗(yàn)評(píng)價(jià)���、體外替代測(cè)試/計(jì)算機(jī)模擬研究及臨床評(píng)價(jià)進(jìn)行分析,并給出建議。由于醫(yī)療器械種類眾多�,其人體接觸/暴露途徑也存在很大差異,具體到某一醫(yī)療器械����,并非上述所有評(píng)價(jià)方法都是必要的。
四���、理化表征
(一)一般原則
醫(yī)療器械的材料表征包括化學(xué)����、物理����、形態(tài)學(xué)和表面等性質(zhì)的表征(GB/T 16886.18和GB/T 16886.19),納米材料表現(xiàn)出獨(dú)特的性質(zhì)取決于它們的大小�����、結(jié)構(gòu)和表面性質(zhì)等不同于常規(guī)材料��。因此�,參與組成器械的納米材料的理化性質(zhì)表征是完成生物學(xué)評(píng)價(jià)的重要一步,可以指導(dǎo)應(yīng)用納米材料醫(yī)療器械生物學(xué)評(píng)價(jià)試驗(yàn)方案的制定�,也對(duì)醫(yī)療器械中新的納米材料進(jìn)行有效篩選給出建設(shè)性意見�。
ISO/TR 13014列出了以下毒理學(xué)試驗(yàn)中需要表征的工程化的納米材料的特性:化學(xué)成分����、純度、尺寸和尺寸分布�、聚集和團(tuán)聚狀態(tài)、形狀����、表面積、表面化學(xué)���、表面電荷��、溶解度和分散度等。
附加屬性的表征可以根據(jù)醫(yī)療器械的設(shè)計(jì)�����、預(yù)期用途和磨損特性來表示���。如結(jié)晶���、孔隙度����、氧化還原電位���、(光)催化��、自由基的形成潛力和辛醇/水系數(shù)(未必適用于固體材料)等�。
除了上述理化表征����,表面具有納米結(jié)構(gòu)的醫(yī)療器械可能需要從形態(tài)學(xué)上進(jìn)行表征。對(duì)于表面結(jié)構(gòu)的有效表征所需測(cè)量的參數(shù)取決于特定的應(yīng)用��。如對(duì)應(yīng)用納米多孔材料的醫(yī)療器械的表征包含但不限于以下信息:孔隙或空隙的尺寸和結(jié)構(gòu)��、密度和分布等�。
(二)表征參數(shù)與方法
ISO/TR 13014提供了與納米材料相關(guān)的生物學(xué)評(píng)價(jià)參數(shù)的詳細(xì)信息和每個(gè)參數(shù)進(jìn)行定量和/或定性分析的方法。隨著對(duì)納米材料的不斷研究和探索��,其表征方法也將不斷改進(jìn)優(yōu)化��,故以上內(nèi)容應(yīng)根據(jù)需要進(jìn)行動(dòng)態(tài)調(diào)整�����。
結(jié)合幾種方法可以同時(shí)研究顆粒大小、形狀�、結(jié)構(gòu)、組成成分和表面性質(zhì)����。單一的表征方法可能無法提供準(zhǔn)確的評(píng)價(jià)參數(shù)(例如粒徑分布、表面配體和表面電荷等)�,建議使用微觀和宏觀多種方法用于一個(gè)特定理化參數(shù)的表征。但需要注意�����,可能對(duì)特定屬性使用不同方法所獲得的結(jié)果不能直接比較����,并且目前幾乎沒有統(tǒng)一方法對(duì)納米材料進(jìn)行理化評(píng)價(jià)以輔助形成可靠的試驗(yàn)方案。申請(qǐng)人宜在醫(yī)療器械中納米材料的類型����、形式以及醫(yī)療器械預(yù)期用途的基礎(chǔ)上選擇表征的方法���。
由于納米材料的表征往往是科學(xué)和技術(shù)上的挑戰(zhàn)�,因此�,申請(qǐng)人宜考慮實(shí)驗(yàn)室的質(zhì)量保證體系和最優(yōu)方案�。納米材料理化表征手段的選擇���、表征結(jié)果和納米材料特性的解釋分析應(yīng)該由經(jīng)過培訓(xùn)且有經(jīng)驗(yàn)的專業(yè)人員進(jìn)行��。在分析過程中����,宜謹(jǐn)慎考慮樣品制備以確保所獲得的數(shù)據(jù)來自該器械中有代表性的材料��。如有可能�,申請(qǐng)人宜在理化表征中采用可獲得的適當(dāng)?shù)膮⒄詹牧希员銓?duì)分析儀器設(shè)備和試驗(yàn)方法進(jìn)行校正和檢驗(yàn)��。表征過程的各個(gè)環(huán)節(jié)應(yīng)仔細(xì)記錄����,以確保結(jié)果的可追溯性和可重復(fù)性。若有必要�,所用方法應(yīng)進(jìn)行方法學(xué)驗(yàn)證被證實(shí)能恰當(dāng)用于納米材料的研究。有關(guān)應(yīng)用納米材料的醫(yī)療器械理化性質(zhì)表征的具體內(nèi)容����,將在本系列指導(dǎo)原則第二部分:應(yīng)用納米材料的醫(yī)療器械理化表征指導(dǎo)原則中給出。
五�、生物學(xué)評(píng)價(jià)
本指導(dǎo)原則僅給出應(yīng)用納米材料醫(yī)療器械生物學(xué)評(píng)價(jià)的概述�。有關(guān)具體內(nèi)容�,將在本系列指導(dǎo)原則第三部分:應(yīng)用納米材料的醫(yī)療器械生物學(xué)評(píng)價(jià)指導(dǎo)原則中給出。
相比于常規(guī)材料����,納米材料在樣品制備時(shí)會(huì)有溶解性和分散性的區(qū)別,因此可能需要考慮納米材料在樣品制備時(shí)的特殊性��;由于納米材料被認(rèn)為可能穿越所有的保護(hù)屏障���,包括血腦屏障和胎盤屏障等�����,因此可能需要考慮納米材料的全身毒性�����,特別是中樞神經(jīng)毒性和生殖毒性��;“納米分子冠”的形成�,可能會(huì)影響其生物響應(yīng)����、動(dòng)力學(xué)、蓄積和毒性等生理效應(yīng)��;有些納米材料具有類佐劑特性���,可能會(huì)對(duì)免疫系統(tǒng)產(chǎn)生影響����,需要關(guān)注免疫毒性�;血液中納米材料暴露的時(shí)間間隔不同可能改變其毒代動(dòng)力學(xué)特征。因此����,應(yīng)用納米材料的醫(yī)療器械生物學(xué)評(píng)價(jià)內(nèi)容,在兼顧常規(guī)器械評(píng)價(jià)內(nèi)容的基礎(chǔ)上�����,重點(diǎn)考慮與納米材料有關(guān)的其他問題�,如樣品制備,吸收���、分布�����、代謝和排泄/清除(ADME)��、全身毒性����、中樞神經(jīng)毒性和免疫毒性等。
(一)樣品制備
樣品制備是對(duì)醫(yī)療器械最終產(chǎn)品及其制造過程中使用的材料進(jìn)行表征和/或生物學(xué)試驗(yàn)時(shí)的一個(gè)關(guān)鍵的多步驟過程��,包括對(duì)器械有代表性取樣�����、浸提液制備��,制備的試驗(yàn)材料的貯存和穩(wěn)定性檢測(cè)等���,應(yīng)重點(diǎn)關(guān)注應(yīng)用納米材料醫(yī)療器械的最終產(chǎn)品在樣品制備不同階段的理化性質(zhì)���。樣品制備具體內(nèi)容詳見GB/T16886.12。
與常規(guī)材料相比較�,納米材料樣品制備時(shí)應(yīng)該考慮的因素包括表面特性增加了其反應(yīng)性,溶解性和分散性的區(qū)別��,聚集物或團(tuán)聚物的形成和微量雜質(zhì)的污染(微量雜質(zhì)可能對(duì)納米材料理化特性和毒理學(xué)特性具有潛在的影響)等。另外�����,納米材料有吸附到容器表面的可能性�����。由重力引起的擴(kuò)散和重力沉降也會(huì)影響納米材料(當(dāng)發(fā)生團(tuán)聚或聚集����、或納米材料由致密物質(zhì)組成等)到細(xì)胞的輸送率�����。納米毒理學(xué)的劑量單位可能不是傳統(tǒng)的質(zhì)量濃度���,而是納米顆粒數(shù)量或總表面積���。
針對(duì)這些問題,有必要針對(duì)應(yīng)用納米材料的醫(yī)療器械制定可靠的樣品制備方案�。
在樣品制備時(shí),需要仔細(xì)分析來確定一個(gè)特殊的納米材料在規(guī)定的實(shí)驗(yàn)條件下是否完全分散���、和/或部分溶解(如一些金屬)還是完全溶解��,因?yàn)槲⑷芑虿蝗艿募{米材料可能以顆粒的形式分散存在于實(shí)驗(yàn)體系中�����。分散可能引起一種不同于從化學(xué)成分預(yù)測(cè)的分子��、離子或元素毒性的反應(yīng)���;而可溶性的納米材料可能出現(xiàn)與相同分子或元素組成的常規(guī)材料相似的反應(yīng)��。
納米材料的分散性受納米材料之間和/或與其所處環(huán)境相互作用的影響�����,分散的納米材料不一定僅以原形存在����,也可能以聚集體或團(tuán)聚體的形式存在��;納米材料的粉末和氣溶膠形式通過表面電荷或空間效應(yīng)則變得不穩(wěn)定�。因此,試驗(yàn)樣品穩(wěn)定性是納米材料生物學(xué)評(píng)價(jià)中獲得準(zhǔn)確���、可靠的試驗(yàn)結(jié)果的關(guān)鍵因素之一�����。
電解質(zhì)濃度����、pH范圍���、離子強(qiáng)度或分子成分(如血清蛋白分子等)對(duì)浸提液制備有顯著影響���。因此,生物學(xué)評(píng)價(jià)試驗(yàn)中應(yīng)用的分散條件應(yīng)盡可能與生理?xiàng)l件一致�。
在應(yīng)用納米材料醫(yī)療器械的成品或原材料的表征、動(dòng)物實(shí)驗(yàn)或體外試驗(yàn)時(shí)����,需要進(jìn)行樣品制備。制備的具體方法可能因接觸途徑和劑量選擇的不同而有差異��。在試驗(yàn)樣品制備和接觸方式的記錄或報(bào)告內(nèi)容中至少應(yīng)包含以下內(nèi)容:
——試驗(yàn)材料的鑒定����、貯存和穩(wěn)定性����,包括批與批之間的差異性���;
——浸提介質(zhì)的化學(xué)組成���;
——合適的劑量單位選擇;
——原料分散劑制備的樣品在給予動(dòng)物(和/或細(xì)胞����、器官、組織)之前的表征�。
作為一般原則,樣品制備的細(xì)節(jié)和所選用方法的基本原理應(yīng)當(dāng)詳細(xì)記錄����。
(二)醫(yī)療器械中納米材料的釋放
一般來說,納米材料從醫(yī)療器械中釋放的最大潛力與器械本身設(shè)計(jì)相關(guān):
——預(yù)期的納米材料釋放��;
——由游離納米材料組成和/或含游離納米材料��,例如用于熱療的氧化鐵納米顆粒����、用于傷口敷料的納米銀和骨填料中的納米材料等�。
某些器械可能涉及多種釋放途徑���,宜綜合考慮釋放特征進(jìn)行分析��。
1.脫落
當(dāng)納米材料作為醫(yī)療器械涂層時(shí)�,應(yīng)考慮脫落的風(fēng)險(xiǎn)���,如作為傷口敷料的納米銀等���。
2.降解釋放
含有或者不含納米材料的醫(yī)療器械�,通過水解反應(yīng)、催化反應(yīng)或磨損等降解方式�,可能會(huì)引起納米材料的釋放。當(dāng)納米材料作為涂層或包埋在可降解基質(zhì)中時(shí)����,可降解材料的生物分解會(huì)導(dǎo)致納米材料的釋放,不含納米材料的醫(yī)療器械通過降解可能導(dǎo)致納米顆粒物的產(chǎn)生�。
當(dāng)納米材料可能通過器械的降解產(chǎn)生時(shí),可參考GB/T16886.9對(duì)醫(yī)療器械潛在降解產(chǎn)物進(jìn)行定性和定量研究��。根據(jù)GB/T16886.9附件A關(guān)于包含的對(duì)降解研究考慮的需要�,如果需要��,降解研究應(yīng)考慮:
a) 器械被設(shè)計(jì)為可吸收的�����;或
b) 器械的預(yù)期植入時(shí)間超過三十天���,或
c) 該材料(多個(gè))系統(tǒng)的相關(guān)信息提示其與機(jī)體接觸的過程中可釋放有毒物質(zhì)。
GB/T16886.13�����、14和15分別包含了聚合物�����、陶瓷����、金屬以及合金降解的一般性原則。
伴有離子釋放的腐蝕也可能導(dǎo)致納米材料的釋放����。對(duì)于某些納米材料,已知釋放的離子可以形成新的納米材料。
3.磨損釋放
來自于器械降解��、磨損或加工處理過程中���,以及在生產(chǎn)過程中未使用納米材料�,但醫(yī)療器械(或部件)在臨床使用過程中通過降解�、磨損或在原位處理過程中(如醫(yī)療器械原位研磨、拋光等)產(chǎn)生納米材料��。許多醫(yī)療器械都可能隨著長(zhǎng)時(shí)間使用導(dǎo)致磨損和納米結(jié)構(gòu)成分(如顆粒等)釋放至周圍環(huán)境���。因此���,如果下述條件適用時(shí),應(yīng)合理論述由磨損釋放的納米材料:
a) 該器械是納米材料�,或
b) 該器械有納米材料涂層����,或
c) 該器械中,其正常使用的情況下�,與生物組織產(chǎn)生摩擦或其組件或與骨填充物或復(fù)合物之間產(chǎn)生摩擦,或者可能
d) 生產(chǎn)過程中的殘留物可能包括納米材料���。
應(yīng)當(dāng)注意的是�����,盡管在制造某些醫(yī)療器械時(shí)不會(huì)使用納米材料�����,但由于磨損可致該醫(yī)療器械(例如植入物和牙科填充材料)產(chǎn)生納米材料����。
4.原位處理釋放
無論醫(yī)療器械是否含有納米材料,該器械進(jìn)行原位處理時(shí)���,例如在牙科處理時(shí)(例如拋光����,研磨)也可能產(chǎn)生納米材料���。
因此����,應(yīng)在類似于預(yù)定用途的生理?xiàng)l件下對(duì)可能釋放的納米材料進(jìn)行全面的鑒定和表征��。且應(yīng)在生理環(huán)境下,對(duì)納米材料的釋放動(dòng)力學(xué)����、數(shù)量、遷移和生物蓄積性進(jìn)行評(píng)估��。
在情形3和4�,即磨損釋放和原位處理釋放的情況下,醫(yī)療器械本身不適用本指導(dǎo)原則�����。但在考慮此類醫(yī)療器械的不良事件和使用風(fēng)險(xiǎn)時(shí)�����,可參考本指導(dǎo)原則適用部分對(duì)可能由產(chǎn)生的納米材料進(jìn)行研究分析����。
(三)毒代動(dòng)力學(xué)
1.一般原則
如果從醫(yī)療器械中釋放的納米材料可以被吸收(Absorption)、分布(Distribution)�、代謝(Metabolism)和/或排泄(Excretion)�,即需要進(jìn)行毒代動(dòng)力學(xué)(ADME)的研究。納米材料的毒代動(dòng)力學(xué)研究可指導(dǎo)生物學(xué)評(píng)價(jià)試驗(yàn)設(shè)計(jì)及結(jié)果解讀�����,應(yīng)被視為應(yīng)用納米材料醫(yī)療器械風(fēng)險(xiǎn)評(píng)估的一部分。GB/T 16886.16給出了關(guān)于如何開展毒代動(dòng)力學(xué)研究的框架�����。對(duì)于應(yīng)用納米材料醫(yī)療器械的毒代動(dòng)力學(xué)研究����,還需要考慮納米材料的理化性質(zhì)、表面特性(如化學(xué)和電荷)����、接觸途徑、劑量效應(yīng)��、動(dòng)物模型�����、研究周期����、浸提方法和分析技術(shù)/手段等因素。
在進(jìn)行毒代動(dòng)力學(xué)研究時(shí)�����,申請(qǐng)人需說明影響該研究設(shè)計(jì)、試驗(yàn)結(jié)果和結(jié)果解讀的因素�。
2.毒代動(dòng)力學(xué)的影響因素
a)理化性質(zhì)
納米材料的尺寸和尺寸分布、形狀���、表面電荷���、聚集和團(tuán)聚、親水性以及表面結(jié)構(gòu)等特性可以影響ADME����。然而到目前為止,哪一特性作為最關(guān)鍵的參數(shù)影響ADME仍不明確����,因此要在對(duì)納米材料進(jìn)行充分表征的基礎(chǔ)上,開展毒代動(dòng)力學(xué)研究����。
b)生物分子吸附
生物環(huán)境中的納米材料在其表面經(jīng)受快速的蛋白質(zhì)、脂質(zhì)等生物分子吸附����,形成納米材料-生物分子復(fù)合物(納米生物分子冠)?!凹{米生物分子冠”改變及賦予納米材料不同于原始狀態(tài)的生物學(xué)特性,影響生物響應(yīng)��、動(dòng)力學(xué)�、蓄積和毒性等生理效應(yīng)。采用與生理環(huán)境相似的模擬液將有助于評(píng)價(jià)生理?xiàng)l件下納米材料表面生物分子吸附特征��,并對(duì)納米材料的生物轉(zhuǎn)化進(jìn)行評(píng)價(jià)��。
c)接觸途徑
接觸途徑能夠影響納米材料的表面特性和生物分布���。吸附在納米材料表面的分子可以進(jìn)一步影響被釋放納米材料的動(dòng)力學(xué)��。因此���,由于不同的接觸途徑,納米材料可以被不同的生物分子覆蓋��,從而影響其毒代動(dòng)力學(xué)特征和毒性�����。
d)劑量效應(yīng)
納米材料的暴露大于機(jī)體清除時(shí)����,則會(huì)導(dǎo)致在體內(nèi)蓄積���,甚至導(dǎo)致組織清除率飽和以及毒代動(dòng)力學(xué)特征的改變。如高劑量和/或重復(fù)接觸的納米材料進(jìn)入血液(例如超出了肝和脾吞噬細(xì)胞的吞噬能力)�,可能造成納米材料在單核巨噬細(xì)胞系統(tǒng)( mononuclear phagocyte system,MPS)以及其他組織的長(zhǎng)期蓄積��,并有可能再次分配進(jìn)入血液�����。因此����,血液中納米材料的暴露可能不足以評(píng)價(jià)納米材料的毒性特征,還應(yīng)密切關(guān)注不同時(shí)間點(diǎn)的組織分布和清除情況���。另外�����,血液中納米材料暴露的時(shí)間間隔不同也可能影響其毒代動(dòng)力學(xué)特征���。
因此���,應(yīng)關(guān)注不同的接觸劑量及接觸頻率對(duì)納米材料的毒代動(dòng)力學(xué)特征和毒性的影響。
e)物種和性別
由于物種和性別之間存在生理學(xué)和解剖學(xué)的差異���,可能會(huì)導(dǎo)致納米材料毒代動(dòng)力學(xué)特征的不同,如雌性比雄性大鼠更容易發(fā)生納米銀及其衍生物的腎臟蓄積��。因此����,毒代動(dòng)力學(xué)和全身毒性研究時(shí)應(yīng)選擇合適的動(dòng)物種屬和性別。
f)測(cè)量技術(shù)
在測(cè)量組織和器官中的納米材料時(shí)��,由于生物背景比較復(fù)雜�,檢測(cè)效能和靈敏度可能會(huì)進(jìn)一步降低。因此��,納米材料或其組成元素的檢測(cè)方法需要排除生物背景的干擾��。
納米材料既可以用放射性或熒光標(biāo)記方法標(biāo)記����,也可通過分析其元素組成來確定。當(dāng)選擇標(biāo)記技術(shù)時(shí)�����,需考慮標(biāo)記物可能從納米材料中釋放和/或標(biāo)記物可能改變納米材料與環(huán)境間的相互作用,從而影響其毒代動(dòng)力學(xué)特征����。
若使用低檢測(cè)限的方法不適用于檢測(cè)組織和器官中極低水平的納米材料時(shí),可考慮對(duì)測(cè)試樣品進(jìn)行額外的處理以便于增加該技術(shù)的靈敏性�����。如果通過增加劑量或重復(fù)給藥來保證在組織/器官中納米材料的可檢測(cè)性����,則可能使單核巨噬細(xì)胞系統(tǒng)攝取納米材料達(dá)到飽和,從而改變納米材料的ADME�。
(四)生物學(xué)評(píng)價(jià)
1.細(xì)胞毒性
建議基于體外試驗(yàn)和已有數(shù)據(jù)與預(yù)期暴露情況相關(guān)性的評(píng)估,參照GB/T 16886.5和YY/T 0993來開展試驗(yàn)����。
在評(píng)估應(yīng)用納米材料醫(yī)療器械的細(xì)胞毒性時(shí),應(yīng)考慮納米材料特性����、細(xì)胞敏感性、特定受體或反應(yīng)機(jī)制等因素?�?筛鶕?jù)預(yù)期使用部位和可能接觸的細(xì)胞類型����,選擇相似的非吞噬性細(xì)胞系和/或吞噬性細(xì)胞系進(jìn)行試驗(yàn)。納米材料本身的特性可能干擾試驗(yàn)體系�����,如納米材料可能會(huì)吸附培養(yǎng)基中的蛋白質(zhì)和/或與某些熒光染料發(fā)生反應(yīng)等��,需要評(píng)估納米材料對(duì)試驗(yàn)體系是否有影響��。另外�����,細(xì)胞毒性試驗(yàn)需要確定納米材料適宜的劑量單位��,如質(zhì)量�、表面積���、質(zhì)量體積濃度或納米顆粒的數(shù)量等��。
2.刺激性和致敏性
GB/T 16886.10描述了醫(yī)療器械及其組成材料產(chǎn)生刺激和皮膚致敏可能性的評(píng)估過程����。
(1)刺激性
根據(jù)GB/T 16886.1標(biāo)準(zhǔn),應(yīng)考慮刺激性試驗(yàn)�,在適宜的模型中使用適當(dāng)?shù)膽?yīng)用部位如皮膚、眼睛和粘膜等�����,評(píng)估醫(yī)療器械�、材料和/或它們的浸提物的潛在刺激性。此要求也適用于應(yīng)用納米材料的醫(yī)療器械��。
(2)致敏性
納米材料本身可能會(huì)導(dǎo)致致敏��,納米材料與蛋白質(zhì)相互作用導(dǎo)致納米材料/蛋白質(zhì)復(fù)合物形成�,其作為一種繼發(fā)效應(yīng)也可能會(huì)導(dǎo)致致敏。由于皮膚的屏障功能�����,納米材料可能到達(dá)致敏的靶細(xì)胞和器官�����、皮膚樹突狀細(xì)胞和引流淋巴結(jié)受限。因此�����,使用GB/T 16886.10中描述的方法評(píng)價(jià)納米材料醫(yī)療器械的致敏性時(shí)����,需要關(guān)注方法的適用性。
3.全身毒性
由于納米材料被認(rèn)為可能穿越所有的生理屏障���,包括血腦屏障和胎盤屏障等��。因此,需要根據(jù)最初的暴露方式��、人體的接觸部位等��,分析是否有游離納米材料進(jìn)入體內(nèi)的可能性�。如果有,則需要考慮納米材料的全身毒性��,特別是神經(jīng)毒性和免疫毒性��。
(1)全身毒性
當(dāng)評(píng)估納米材料的全身毒性時(shí)��,溶解度是需要考慮的一個(gè)關(guān)鍵參數(shù)。水溶性納米材料在接觸組織或體液時(shí)會(huì)溶解���,可能表現(xiàn)出與常規(guī)材料相似的毒性反應(yīng)����,但難溶的納米材料可能使機(jī)體的清除能力和防御機(jī)制很快被耗盡���,從而導(dǎo)致體內(nèi)蓄積和全身不良反應(yīng)����。
經(jīng)評(píng)估應(yīng)用納米材料的醫(yī)療器械具有全身毒性風(fēng)險(xiǎn)時(shí)���,需要進(jìn)行全身毒性評(píng)價(jià)�����。應(yīng)參考GB/T 16886.11所述�����,基于臨床使用情況�、納米材料的特性���、暴露時(shí)間和毒代動(dòng)力學(xué)研究����,來評(píng)估應(yīng)用納米材料醫(yī)療器械的全身毒性。
因?yàn)榧{米材料可能分布于全身���,應(yīng)在具體問題具體分析的基礎(chǔ)上����,考慮預(yù)期用于組織病理學(xué)分析的組織/器官選擇�,特別注意單核巨噬細(xì)胞系統(tǒng)(特別是肝、脾)��、腎�、腦、骨髓����、淋巴結(jié)等�����。另外��,劑量單位、劑量大小����、接觸頻率和接觸時(shí)間也可影響全身毒性試驗(yàn)結(jié)果。
(2)神經(jīng)毒性
納米材料可以直接或間接與神經(jīng)系統(tǒng)接觸�����,如:納米材料可能通過鼻黏膜-嗅球-感覺神經(jīng)到達(dá)中樞神經(jīng)�����,另外����,納米材料還可能透過血腦屏障,進(jìn)入中樞神經(jīng)系統(tǒng)����。由于神經(jīng)細(xì)胞清除納米材料的速度非常緩慢(溶解和清除),可能導(dǎo)致納米材料在腦內(nèi)蓄積產(chǎn)生毒性����。因此,應(yīng)用納米材料的醫(yī)療器械應(yīng)關(guān)注納米材料與神經(jīng)系統(tǒng)接觸的可能性��、分布特征、蓄積性���、與神經(jīng)細(xì)胞的反應(yīng)活性及對(duì)中樞神經(jīng)系統(tǒng)功能的影響���。
經(jīng)評(píng)估應(yīng)用納米材料的醫(yī)療器械具有神經(jīng)毒性風(fēng)險(xiǎn)時(shí),需要進(jìn)行神經(jīng)毒性評(píng)價(jià)�����。神經(jīng)毒性評(píng)價(jià)可以分層次地開展體外和體內(nèi)神經(jīng)毒性試驗(yàn)�����。體外神經(jīng)毒性試驗(yàn)主要涉及兩種類型���,即活力測(cè)定和功能測(cè)定�。體內(nèi)動(dòng)物實(shí)驗(yàn)可結(jié)合亞慢��、長(zhǎng)期毒性研究或功能組合觀察試驗(yàn)(FOB)����,通過一系列指標(biāo)評(píng)價(jià)納米材料的神經(jīng)毒性���,例如神經(jīng)系統(tǒng)組織病理學(xué)檢查����、神經(jīng)元及膠質(zhì)細(xì)胞毒性評(píng)價(jià)(特異性免疫染色)和動(dòng)物中樞神經(jīng)系統(tǒng)功能的改變等,如有必要����,可增加神經(jīng)遞質(zhì)、神經(jīng)元結(jié)構(gòu)及炎癥因子等指標(biāo)����。
(3)免疫毒性
免疫系統(tǒng)暴露于納米材料可能導(dǎo)致炎癥或過敏性/自身免疫反應(yīng)等。其程度和反應(yīng)類型取決于納米材料的特性����、類佐劑效應(yīng)、炎性作用以及其激活補(bǔ)體系統(tǒng)的能力�����、免疫應(yīng)答后可被激發(fā)或抑制等方面因素����。
納米材料進(jìn)入全身循環(huán)系統(tǒng)后,主要終結(jié)于單核巨噬細(xì)胞系統(tǒng)�。因此����,納米材料的免疫毒性可能需要特殊考慮�����。GB/T16886.20描述了免疫毒性試驗(yàn)總體考慮�。如果需要評(píng)估免疫毒性,可伴隨重復(fù)接觸毒性試驗(yàn)進(jìn)行初步評(píng)估�,通過此試驗(yàn)可檢測(cè)到的免疫抑制和/或免疫刺激的一般指征。
如果需要進(jìn)一步評(píng)估免疫毒性�,可采用體外模型進(jìn)行。體外模型提供了可靠的研究免疫細(xì)胞功能的方法��,可評(píng)估免疫細(xì)胞的吞噬功能�����、趨化性��、炎性因子和一氧化氮產(chǎn)生等指標(biāo)�����。也可在特殊的免疫細(xì)胞中,通過信號(hào)通路評(píng)價(jià)納米材料對(duì)免疫細(xì)胞功能的影響�����,如核因子kappaB通路��。
4.熱原
由于納米材料具有較大的比表面積����,其表面極易吸附微生物及其內(nèi)毒素(LPS)等����,從而增加了熱原反應(yīng)風(fēng)險(xiǎn)?�?蓞⒖糋B/T16886-11及YY/T 1295給出的試驗(yàn)方法進(jìn)行應(yīng)用納米材料的醫(yī)療器械內(nèi)毒素檢測(cè)�����。在評(píng)價(jià)熱原反應(yīng)過程中�,要考慮納米材料是否對(duì)試驗(yàn)系統(tǒng)有影響。其它可參考的信息包括:?jiǎn)魏思?xì)胞激活試驗(yàn)(MAT)及相關(guān)美國(guó)藥典和標(biāo)準(zhǔn)(USP85��,USP151和ANSI/AAMI ST72)中關(guān)于熱原反應(yīng)評(píng)價(jià)方法���。
除內(nèi)毒素介導(dǎo)的致熱性外��,也需考慮非內(nèi)毒素介導(dǎo)的致熱性��。應(yīng)用納米材料的醫(yī)療器械介導(dǎo)的熱原反應(yīng)作為生物學(xué)評(píng)價(jià)的一部分�,具體方法參照GB/T16886.11和中國(guó)藥典。
5.植入
GB/T16886.6中描述了醫(yī)療器械體內(nèi)植入試驗(yàn)���。根據(jù)醫(yī)療器械類型可以考慮不同植入部位(例如皮下��、肌內(nèi)�、顱內(nèi)等)����。對(duì)于游離納米材料,可考慮直接注射到相應(yīng)的組織�����。
如果醫(yī)療器械中納米材料有釋放的可能性時(shí)���,應(yīng)當(dāng)特別注意納米材料向局部引流淋巴結(jié)的遷移�����。
當(dāng)采用原位植入試驗(yàn)評(píng)估潛在的全身毒性時(shí)��,應(yīng)考慮GB/T16886.6和GB/T16886.11的要求��。
6.血液相容性
應(yīng)對(duì)直接或間接接觸血液的應(yīng)用納米材料的醫(yī)療器械進(jìn)行血液相容性評(píng)價(jià)����。此外�����,即使對(duì)非血液接觸的器械����,如果毒代動(dòng)力學(xué)研究顯示來自醫(yī)療器械的游離納米材料可能進(jìn)入全身血液循環(huán)時(shí),也應(yīng)進(jìn)行血液相容性評(píng)估�����。
可參考GB/T16886.4和YY/T 1532-2017中描述的評(píng)估策略和常規(guī)方法評(píng)價(jià)應(yīng)用納米材料的醫(yī)療器械血液相容性��。根據(jù)被檢測(cè)的初始過程或系統(tǒng)將血液相互作用分為幾類:血液學(xué)����、血栓形成��、凝血���、血小板活化和補(bǔ)體系統(tǒng)激活。
可以合理地直接使用GB/T16886.4中描述的常規(guī)方法對(duì)表面具有納米材料(非游離狀態(tài))的醫(yī)療器械進(jìn)行評(píng)價(jià)�����。由于納米材料具有更高的比表面積��,血液中大量的血清蛋白可輕易地吸附于游離納米材料�,改變其進(jìn)入血液后的級(jí)聯(lián)反應(yīng),因此�����,游離納米材料的血液相容性評(píng)價(jià)可能更具有挑戰(zhàn)性��。另外�����,納米材料與血液接觸后潛在的聚集/團(tuán)聚也會(huì)改變與血小板�����、凝血因子和血管內(nèi)皮細(xì)胞的相互作用。
以上因素可能對(duì)體外試驗(yàn)產(chǎn)生干擾���,在得出關(guān)于游離納米材料血液相容性任何結(jié)論前應(yīng)特別注意所使用方法的重現(xiàn)性���、可靠性和靈敏度。若體外試驗(yàn)不足以評(píng)價(jià)納米材料的血液相容性時(shí)��,可考慮采用體內(nèi)試驗(yàn)���,比如通過檢測(cè)血液學(xué)、血生化相關(guān)指標(biāo)(如紅細(xì)胞計(jì)數(shù)�、血紅蛋白、總膽紅素���、直接/間接膽紅素等)來綜合評(píng)價(jià)納米材料的血液相容性����。
納米材料和補(bǔ)體系統(tǒng)之間的相互作用受納米材料的尺寸�����、形態(tài)和表面特性等因素影響��。血液中納米材料導(dǎo)致補(bǔ)體系統(tǒng)激活的異常增強(qiáng)可能誘發(fā)顯著性炎癥反應(yīng)及急性過敏反應(yīng)。因此���,在存在全身暴露的情況時(shí)�����,補(bǔ)體激活應(yīng)作為應(yīng)用納米材料醫(yī)療器械風(fēng)險(xiǎn)評(píng)估的一部分���。
7.遺傳毒性、致癌性和生殖毒性
GB/T 16886.3適用于已識(shí)別或未知的可能有遺傳毒性��、致癌性和生殖毒性的醫(yī)療器械或組件的評(píng)價(jià)��。與常規(guī)器械相比�����,應(yīng)用納米材料的醫(yī)療器械可能具有不同的遺傳毒性��、致癌性和生殖毒性����。
(1)遺傳毒性
納米材料可以透過細(xì)胞膜,進(jìn)入細(xì)胞核并與遺傳物質(zhì)(DNA或染色體)相互作用��。也可能通過氧化應(yīng)激或炎癥等作用機(jī)制誘發(fā)染色體或DNA斷裂。因此��,納米材料的遺傳毒性風(fēng)險(xiǎn)可能是直接或間接機(jī)制的結(jié)果����,可能表現(xiàn)為基因突變和/或染色體損傷。
遺傳毒性評(píng)價(jià)的最終目的是預(yù)測(cè)供試品潛在的致癌性或其它可遺傳的危害���。對(duì)遺傳毒性試驗(yàn)結(jié)果進(jìn)行評(píng)價(jià)時(shí)��,應(yīng)結(jié)合納米材料的作用特點(diǎn)���、毒代動(dòng)力學(xué)和其他毒理學(xué)研究的結(jié)果等信息進(jìn)行綜合分析�。遺傳毒性試驗(yàn)組合可減少假陰性結(jié)果的風(fēng)險(xiǎn)。此外���,任何一項(xiàng)遺傳毒性試驗(yàn)中的陽性結(jié)果并不一定說明供試品對(duì)人類真正具有遺傳毒性或致癌性的風(fēng)險(xiǎn)��。
評(píng)價(jià)供試品的潛在遺傳毒性時(shí)�,應(yīng)全面考慮各項(xiàng)試驗(yàn)結(jié)果����、體內(nèi)和體外試驗(yàn)方法的內(nèi)在價(jià)值及其局限性��,進(jìn)行綜合分析與評(píng)價(jià)�。
a)體外遺傳毒性
對(duì)于應(yīng)用納米材料醫(yī)療器械的遺傳毒性評(píng)價(jià)�,應(yīng)優(yōu)先開展體外遺傳毒性試驗(yàn)。傳統(tǒng)的細(xì)菌回復(fù)突變?cè)囼?yàn)(Ames)體系存在一些局限��,導(dǎo)致納米材料不易與細(xì)菌的遺傳物質(zhì)充分接觸�,而有些納米材料(如,納米銀及其釋放的銀離子等)自身也有一定的抑菌作用���。因此���,開展細(xì)菌回復(fù)突變?cè)囼?yàn)時(shí),應(yīng)提供所用試驗(yàn)條件下細(xì)菌對(duì)該納米材料攝取能力以及納米材料溶解性的資料����,作為結(jié)果判定的參考。小鼠淋巴瘤tk基因突變?cè)囼?yàn)涵蓋了基因突變和染色體斷裂兩個(gè)檢測(cè)終點(diǎn)����,可考慮作為第二項(xiàng)納米材料潛在致突變能力的檢測(cè)方法。體外微核試驗(yàn)或體外染色體畸變?cè)囼?yàn)在檢測(cè)終點(diǎn)上與Ames試驗(yàn)和小鼠淋巴瘤tk基因突變?cè)囼?yàn)互補(bǔ)�,可考慮任選一項(xiàng)作為第三項(xiàng)遺傳毒性評(píng)價(jià)方法。在提供相應(yīng)研究數(shù)據(jù)的同時(shí)應(yīng)提供研究所用試驗(yàn)條件下細(xì)胞對(duì)該納米材料攝取能力、納米材料溶解性以及納米材料對(duì)試驗(yàn)體系的干擾���,作為試驗(yàn)結(jié)果判定的參考�����。
b)體內(nèi)遺傳毒性
首先應(yīng)基于體外遺傳毒性研究結(jié)果和GB/T 16886.3的要求評(píng)估是否需要開展體內(nèi)遺傳試驗(yàn)����。
進(jìn)行體內(nèi)試驗(yàn)時(shí)�����,應(yīng)證實(shí)納米材料可在取材時(shí)間點(diǎn)到達(dá)取材的組織/器官����。建議基于毒代動(dòng)力學(xué)研究和/或亞慢性體內(nèi)研究以確定取材組織/器官,并基于預(yù)期人群的接觸途徑和靶器官來制定應(yīng)用納米材料的醫(yī)療器械體內(nèi)遺傳毒性的評(píng)價(jià)策略�。常用的體內(nèi)遺傳毒性試驗(yàn)包括:嚙齒類動(dòng)物紅細(xì)胞微核試驗(yàn)�、哺乳動(dòng)物骨髓染色體畸變?cè)囼?yàn)和嚙齒類動(dòng)物體內(nèi)彗星試驗(yàn)。
(2)致癌性
體外和體內(nèi)研究提示納米材料可誘導(dǎo)DNA損傷和突變��?����;蛲蛔儭⑷旧w損傷或重組等遺傳物質(zhì)損傷被認(rèn)為具有遺傳效應(yīng)���,也是決定惡性腫瘤多階段發(fā)展的重要因素���。某些致突變/遺傳毒性化合物的暴露與致癌性之間存在明確相關(guān)性,遺傳毒性試驗(yàn)結(jié)果對(duì)供試品的致癌性有一定提示作用��?��?筛鶕?jù)具體納米材料的作用特點(diǎn)及機(jī)制����,并參考遺傳毒性試驗(yàn)結(jié)果��,決定是否有必要進(jìn)一步開展致癌性試驗(yàn)��。
另外��,如果人體高劑量或長(zhǎng)期暴露應(yīng)考慮評(píng)估致癌風(fēng)險(xiǎn)����。應(yīng)根據(jù)GB/T 16886.3的要求考慮應(yīng)用納米材料的醫(yī)療器械致癌性評(píng)估,同時(shí)也可參考評(píng)估化學(xué)物致癌可能性的體內(nèi)試驗(yàn),如ECB.32及OECD 451中描述的致癌性試驗(yàn)和ECB.33及OECD 453描述的慢性致癌性聯(lián)合試驗(yàn)���。與兩年致癌性研究相比���,轉(zhuǎn)基因動(dòng)物,如鼠rasH2模型可用作短期替代試驗(yàn)�����。
在開展應(yīng)用納米材料醫(yī)療器械的致癌性實(shí)驗(yàn)時(shí)�����,需結(jié)合納米材料的特性���,可能的暴露途徑和暴露方式���,暴露時(shí)間等,科學(xué)合理地設(shè)計(jì)能夠反映實(shí)際暴露情況的試驗(yàn)方案����。
(3)生殖毒性
納米材料具有能夠穿透生殖系統(tǒng)屏障(例如血睪屏障和胎盤屏障等)���,影響精子的活力和功能以及胚胎發(fā)育的可能性���。另外���,納米材料通過與DNA分子相互作用導(dǎo)致的遺傳物質(zhì)損傷也可能導(dǎo)致突變和影響下一代的生殖和發(fā)育。應(yīng)根據(jù)GB/T 16886.3的要求和ADME的研究數(shù)據(jù)對(duì)應(yīng)用納米材料的醫(yī)療器械生殖毒性進(jìn)行評(píng)估���。
(五)風(fēng)險(xiǎn)評(píng)估
風(fēng)險(xiǎn)評(píng)估最重要的因素是納米材料從醫(yī)療器械中釋放的可能性�,按照GB/T 16886.1要求進(jìn)行風(fēng)險(xiǎn)評(píng)估�。
與納米材料釋放相關(guān)的風(fēng)險(xiǎn)評(píng)估的階段性方法在下面提出,并在圖2中展示�。
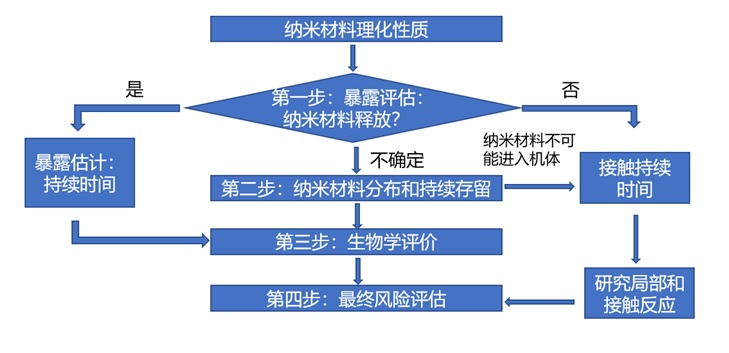
圖2:應(yīng)用納米材料的醫(yī)療器械風(fēng)險(xiǎn)評(píng)估:階段法
1.第一階段:暴露評(píng)估(納米材料釋放)
第一階段的目的是通過體外納米材料釋放實(shí)驗(yàn),在模擬臨床實(shí)際應(yīng)用中最不利的情況下���,考慮無論從材料的屬性和應(yīng)用類型����,還是由于植入后的磨損�����,結(jié)合已有資料及文獻(xiàn)分析�,綜合評(píng)估納米材料釋放的可能性以及潛在暴露風(fēng)險(xiǎn)��。
當(dāng)納米材料存在釋放的可能性時(shí)����,需要進(jìn)行理化表征以確定釋放材料的性質(zhì)���、釋放速率和可能對(duì)其產(chǎn)生影響的因素����,并進(jìn)一步開展生物學(xué)評(píng)價(jià)�。如果納米材料不存在釋放的可能性,進(jìn)一步評(píng)價(jià)可以僅限于局部反應(yīng)�����。如果存在納米材料潛在釋放的不確定性�,應(yīng)開展第二階段評(píng)估。
2.第二階段:納米材料分布和持續(xù)存留
這一階段的主要目的是通過體內(nèi)實(shí)驗(yàn)��,識(shí)別游離納米材料的生物分布和蓄積����。可結(jié)合第五章第三部分毒代動(dòng)力學(xué)內(nèi)容進(jìn)行評(píng)估����,以應(yīng)對(duì)在第三階段(如下)中上述潛在暴露場(chǎng)景中所需的生物學(xué)評(píng)價(jià)�����。
無創(chuàng)(皮膚接觸)和/或有創(chuàng)器械作用于人體部位所釋放的納米材料的吸收和接觸持續(xù)時(shí)間,對(duì)納米材料向其它器官的潛在分布具有重要影響�,需進(jìn)一步考慮納米材料在其釋放的生物介質(zhì)中的持續(xù)存留/穩(wěn)定性。
對(duì)于無創(chuàng)器械���,首先需要評(píng)估納米材料進(jìn)入全身循環(huán)的潛力�����,如果能夠得出在最差使用條件下���,納米材料都不可能進(jìn)入全身循環(huán),通常僅限于接觸部位的局部反應(yīng)��。
對(duì)于有創(chuàng)器械����,需要通過更詳細(xì)的毒代動(dòng)力學(xué)研究,評(píng)估游離的納米材料進(jìn)入并保留在特定組織中的潛力�����。從以上研究中的發(fā)現(xiàn),可能影響下一步生物學(xué)評(píng)價(jià)方法的選擇���。
3.第三階段:危害識(shí)別(生物學(xué)評(píng)價(jià))
如果第一階段和/或第二階段沒有識(shí)別出納米材料的釋放��,醫(yī)療器械的局部效應(yīng)可以參照GB/T 16886.1中已有的試驗(yàn)方法�����。
如果存在納米材料釋放�����,則需要附加試驗(yàn)����。如果從第二階段評(píng)估到納米材料釋放不太可能進(jìn)入全身循環(huán)�,則僅需進(jìn)行局部效應(yīng)的試驗(yàn);如果當(dāng)納米材料在一個(gè)或多個(gè)組織暴露時(shí)�,應(yīng)考慮必要的附加試驗(yàn),如ADME�、免疫毒性、遺傳毒性�����、亞慢性、慢性毒性��、生殖毒性和神經(jīng)毒性等試驗(yàn)�����。
為了能夠客觀地評(píng)估納米材料的潛在風(fēng)險(xiǎn)����,可能需要對(duì)現(xiàn)有的試驗(yàn)方法進(jìn)行改進(jìn)���。
4.第四階段:風(fēng)險(xiǎn)評(píng)估
當(dāng)毒性由所用的(目標(biāo))納米材料引起時(shí)�,必須對(duì)劑量效應(yīng)關(guān)系給予特別關(guān)注�����。在研究中的毒性反應(yīng)與在靶器官(內(nèi)部暴露)中檢測(cè)到的納米材料水平進(jìn)行比較��,以評(píng)價(jià)風(fēng)險(xiǎn)����。評(píng)估的風(fēng)險(xiǎn)可以與不含納米材料的可比醫(yī)療器械相比�����,并根據(jù)YY/T 0316進(jìn)行評(píng)估��。除評(píng)估出的潛在風(fēng)險(xiǎn)之外�,在最終受益風(fēng)險(xiǎn)評(píng)價(jià)中也要考慮患者的潛在受益�����。
六�����、動(dòng)物實(shí)驗(yàn)
醫(yī)療器械安全性和有效性評(píng)價(jià)研究應(yīng)采用科學(xué)����、合理的評(píng)價(jià)方法,其中動(dòng)物實(shí)驗(yàn)是重要手段之一�,其屬于產(chǎn)品設(shè)計(jì)開發(fā)中的重要研究?jī)?nèi)容,可為產(chǎn)品設(shè)計(jì)定型提供相應(yīng)的證據(jù)支持���,可為醫(yī)療器械能否用于人體研究提供支持�,降低臨床試驗(yàn)受試者及使用者的風(fēng)險(xiǎn)以及為臨床試驗(yàn)設(shè)計(jì)提供參考。結(jié)合動(dòng)物實(shí)驗(yàn)的目的��,一般從可行性�����、安全性和有效性三方面進(jìn)行考慮�����。
本指導(dǎo)原則僅給出應(yīng)用納米材料的醫(yī)療器械動(dòng)物實(shí)驗(yàn)的概述����。有關(guān)動(dòng)物實(shí)驗(yàn)的具體內(nèi)容�,將在本系列指導(dǎo)原則第四部分:應(yīng)用納米材料的醫(yī)療器械動(dòng)物實(shí)驗(yàn)指導(dǎo)原則中給出。
(一)可行性
可行性研究是指產(chǎn)品設(shè)計(jì)開發(fā)階段進(jìn)行的�,對(duì)產(chǎn)品工作原理、作用機(jī)理����、設(shè)計(jì)、可操作性�����、功能性、安全性等方面進(jìn)行確認(rèn)/驗(yàn)證��,或識(shí)別新的非預(yù)期風(fēng)險(xiǎn)的研究��。
納米技術(shù)是正在快速發(fā)展的新興領(lǐng)域�����,在設(shè)計(jì)開發(fā)應(yīng)用納米材料的醫(yī)療器械時(shí)�,會(huì)有許多新的工作原理、作用機(jī)理����、設(shè)計(jì)和材料專屬特性等理念出現(xiàn),如何驗(yàn)證這些新理念是否可行以及器械性能是否有效���,動(dòng)物實(shí)驗(yàn)是重要的手段之一��。
當(dāng)通過臺(tái)架試驗(yàn)或體外測(cè)試等試驗(yàn)不能完全評(píng)估其可行性時(shí)���,可能需要通過動(dòng)物實(shí)驗(yàn)來評(píng)估其可行性,如溫敏納米凝膠血管栓塞劑各組分不同比例的篩選����,以及選擇使用介入導(dǎo)管尺寸和材料的篩選等。
(二)安全性
相比于常規(guī)材料,由于納米材料被認(rèn)為可能穿越所有的保護(hù)屏障���,包括血腦屏障和胎盤屏障等����,因此����,應(yīng)用納米材料的醫(yī)療器械可能需要考慮ADME以及全身毒性、中樞神經(jīng)毒性和免疫毒性等��。
同時(shí)由于納米材料的特性�����,在對(duì)應(yīng)用納米材料的醫(yī)療器械的毒代動(dòng)力學(xué)���、毒理學(xué)以及生物學(xué)反應(yīng)等方面進(jìn)行評(píng)估和研究時(shí),有些試驗(yàn)(如亞慢性毒性��、植入后局部反應(yīng)等)通過采用浸提液或與臨床非一致的接觸方式開展時(shí)����,可能不足以模擬器械在臨床上真實(shí)的瀝濾物特征和生物學(xué)反應(yīng)。應(yīng)用納米材料醫(yī)療器械浸提液的接觸頻率和部位與原位持續(xù)接觸和釋放的不同可能引起毒代動(dòng)力學(xué)參數(shù)的差異,以及進(jìn)一步引起毒性的差異�,因此,相較于采用浸提液的部分生物學(xué)評(píng)價(jià)試驗(yàn)相比���,動(dòng)物實(shí)驗(yàn)可能會(huì)更有助于對(duì)應(yīng)用納米材料的醫(yī)療器械進(jìn)行安全性評(píng)價(jià)���。
當(dāng)開展毒代動(dòng)力學(xué)和毒理學(xué)研究與評(píng)價(jià)時(shí),使用與臨床一致原位暴露方式相對(duì)于使用浸提液的方式����,有以下幾方面的優(yōu)勢(shì):
(1)避免應(yīng)用納米材料醫(yī)療器械基于GB/T16886.12制備浸提液的局限性。
(2)避免浸提液方式無法完全模擬臨床可瀝濾物真實(shí)的接觸情況��。
(3)與臨床相同的原位暴露方式可以更好地評(píng)估局部組織反應(yīng)�����。
(4)在同一組動(dòng)物身上同時(shí)評(píng)價(jià)局部反應(yīng)���、全身毒性和毒代動(dòng)力學(xué)等��,可對(duì)器械進(jìn)行整體的安全性評(píng)估����,也有利于結(jié)果的系統(tǒng)性解讀。
采用動(dòng)物實(shí)驗(yàn)研究對(duì)常規(guī)產(chǎn)品的部分安全性指標(biāo)進(jìn)行評(píng)價(jià)的項(xiàng)目���,應(yīng)用納米材料的醫(yī)療器械同樣適用�。
(三)有效性
納米技術(shù)是正在快速發(fā)展的新興領(lǐng)域���,大多數(shù)應(yīng)用納米材料的醫(yī)療器械還沒有上市�����,在進(jìn)行風(fēng)險(xiǎn)評(píng)估時(shí)�,可能無法與已上市同類產(chǎn)品進(jìn)行等同性比較��。相關(guān)產(chǎn)品僅僅依靠常規(guī)的實(shí)驗(yàn)室研究并不能驗(yàn)證失效風(fēng)險(xiǎn)���,也無法為臨床試驗(yàn)設(shè)計(jì)提供足夠的資料支持�����,因此,需要通過適宜的動(dòng)物模型來評(píng)價(jià)應(yīng)用納米材料的醫(yī)療器械在動(dòng)物體內(nèi)的性能和產(chǎn)品有效性����,如溫敏納米凝膠血管栓塞劑的血管栓塞性能評(píng)價(jià)��,功能化納米水凝膠肌組織修復(fù)材料引導(dǎo)組織重建的有效性評(píng)價(jià)等�。
試驗(yàn)?zāi)康挠袝r(shí)是不能嚴(yán)格劃分界限的����,因此一項(xiàng)動(dòng)物實(shí)驗(yàn)可能同時(shí)對(duì)產(chǎn)品的可行性、安全性和有效性進(jìn)行評(píng)價(jià)���。
開展動(dòng)物實(shí)驗(yàn)要在有資質(zhì)的場(chǎng)所進(jìn)行�,并且該單位或機(jī)構(gòu)應(yīng)建立相應(yīng)的質(zhì)量管理體系����,并維護(hù)體系保持有效運(yùn)行,按照《醫(yī)療器械動(dòng)物實(shí)驗(yàn)研究技術(shù)審查指導(dǎo)原則第一部分:決策原則》(2019年第18號(hào))的要求進(jìn)行�。
在通過動(dòng)物實(shí)驗(yàn)方式評(píng)價(jià)應(yīng)用納米材料醫(yī)療器械的生物相容性時(shí),應(yīng)符合GB/T 16886系列標(biāo)準(zhǔn)等生物學(xué)評(píng)價(jià)相關(guān)技術(shù)文件�����。
七�����、體外替代測(cè)試/計(jì)算機(jī)模擬研究
基于實(shí)驗(yàn)動(dòng)物代替����、減少和優(yōu)化(3R)原則�����,在一些領(lǐng)域正在開發(fā)替代的試驗(yàn)方法���,如體外替代測(cè)試和計(jì)算機(jī)模擬研究。在評(píng)價(jià)醫(yī)療器械安全性和有效性時(shí)����,如果方法得到驗(yàn)證,可以考慮使用����。另外,在一些器械性能方面研究或驗(yàn)證時(shí)����,也可考慮使用該方法。
體外替代測(cè)試:目前包括皮膚腐蝕試驗(yàn)�、皮膚刺激試驗(yàn)、經(jīng)皮膚吸收試驗(yàn)����、眼刺激試驗(yàn)、皮膚致敏試驗(yàn)�����、光毒性試驗(yàn)�����、內(nèi)分泌干擾試驗(yàn)����、胚胎毒性試驗(yàn)、血液毒性試驗(yàn)���、遺傳毒性���、熱原試驗(yàn)等毒理學(xué)測(cè)試。這些方法被歐洲藥典�����、人用藥品注冊(cè)技術(shù)要求國(guó)際協(xié)調(diào)委員會(huì)(ICH)等法規(guī)接受�。在確認(rèn)了適用性基礎(chǔ)上可以考慮采用體外替代測(cè)試方法。
計(jì)算機(jī)模擬研究:主要包括定量構(gòu)效關(guān)系(QSAR, Quantitative Structure-Activity Relationship)�����、分類法、交叉參照�����、毒理學(xué)閾值和專家系統(tǒng)等����。已經(jīng)有不少Q(mào)SAR模型和工具應(yīng)用到毒理學(xué)安全性評(píng)估中,例如���,OECD QSAR Toolbox�����、Toxtree�、CAESAR�、TEST及HESS等,其評(píng)價(jià)的毒性終點(diǎn)涉及經(jīng)皮吸收����、皮膚刺激、眼刺激、皮膚致敏���、急性毒性�����、重復(fù)劑量染毒、生殖發(fā)育�、遺傳和致癌等。
目前��,國(guó)內(nèi)外發(fā)布的替代方法標(biāo)準(zhǔn)���,對(duì)于工業(yè)化學(xué)品的部分毒性評(píng)價(jià)也能提供基本的測(cè)試數(shù)據(jù)���。但在實(shí)際應(yīng)用中仍需要積累數(shù)據(jù),進(jìn)行必要的優(yōu)化和調(diào)整��。使用者可以通過增加檢測(cè)參數(shù)��、改變暴露方式���、修改預(yù)測(cè)模型和組合等不同方法提高方法的特異性��。在選擇體外替代測(cè)試和計(jì)算機(jī)模擬研究時(shí)���,可根據(jù)國(guó)內(nèi)法規(guī)要求選擇相應(yīng)的替代測(cè)試對(duì)納米材料進(jìn)行毒理學(xué)測(cè)試����,必要時(shí)需要對(duì)方法進(jìn)行優(yōu)化和調(diào)整���。
需要指出的是:當(dāng)前科學(xué)界也正在開發(fā)用于納米材料有效性評(píng)價(jià)和篩選的體外替代測(cè)試方法和計(jì)算機(jī)模擬方法���,如體外三維組織/器官模型、有限元分析����。這些方法對(duì)于現(xiàn)有的臺(tái)架試驗(yàn)和動(dòng)物實(shí)驗(yàn)是有益的補(bǔ)充。但申請(qǐng)人在采用這些方法對(duì)納米材料開展評(píng)價(jià)時(shí)��,也應(yīng)充分考慮方法的局限性和適用性�����,特別是模型與真實(shí)人體健康組織和病變部位的差別對(duì)于結(jié)果解釋造成的可能影響�。有關(guān)體外替代測(cè)試和計(jì)算機(jī)模擬的具體內(nèi)容,將在本系列指導(dǎo)原則第五部分:應(yīng)用納米材料的醫(yī)療器械體外替代測(cè)試/計(jì)算機(jī)模擬指導(dǎo)原則中給出�。
八���、臨床評(píng)價(jià)
(一)一般考慮
本指導(dǎo)原則僅給出應(yīng)用納米材料醫(yī)療器械臨床評(píng)價(jià)的概述。有關(guān)臨床評(píng)價(jià)的具體內(nèi)容��,將在本系列指導(dǎo)原則第六部分:應(yīng)用納米材料的醫(yī)療器械臨床評(píng)價(jià)指導(dǎo)原則中給出����。
應(yīng)用納米材料的醫(yī)療器械臨床評(píng)價(jià)應(yīng)按照《醫(yī)療器械監(jiān)督管理?xiàng)l例》《醫(yī)療器械注冊(cè)管理辦法》《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》和《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》等進(jìn)行。
(二)臨床試驗(yàn)
當(dāng)前��,大部分應(yīng)用納米材料的醫(yī)療器械未有人體使用史�����,無法與已上市產(chǎn)品進(jìn)行同品種比對(duì)����;另外由于動(dòng)物與人體的差異�,僅僅通過非臨床研究,很難評(píng)價(jià)其安全性和有效性��。因此����,對(duì)于大部分應(yīng)用納米材料的醫(yī)療器械,需要開展臨床試驗(yàn)。但通過對(duì)同品種醫(yī)療器械臨床試驗(yàn)或者臨床使用獲得的數(shù)據(jù)進(jìn)行分析評(píng)價(jià)�����,能夠證明該醫(yī)療器械安全��、有效的���,可以在申報(bào)注冊(cè)時(shí)予以說明�����,并提交相關(guān)證明資料�。
需要開展臨床試驗(yàn)的應(yīng)用納米材料的醫(yī)療器械應(yīng)按照《醫(yī)療器械監(jiān)督管理?xiàng)l例》《醫(yī)療器械注冊(cè)管理辦法》《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》��,以及《醫(yī)療器械臨床評(píng)價(jià)指導(dǎo)原則》等要求��,合理設(shè)計(jì)臨床試驗(yàn)方案��;知情同意書設(shè)計(jì)要符合要求�����,重點(diǎn)描述風(fēng)險(xiǎn)�、補(bǔ)償����、受益��、替代治療方案���,不良事件的處理等��。
(三)特殊考慮
除醫(yī)療器械臨床試驗(yàn)的一般性要求外����,在整個(gè)臨床試驗(yàn)中�,還應(yīng)時(shí)刻關(guān)注納米材料的潛在暴露風(fēng)險(xiǎn)����,進(jìn)行代謝學(xué)研究,以及醫(yī)療器械的性能研究�。在長(zhǎng)期安全性研究過程中,申請(qǐng)人宜根據(jù)醫(yī)療器械預(yù)期用途����,納米材料與人體可能的接觸/暴露途徑,以及納米材料可能的靶器官/組織�,設(shè)計(jì)有針對(duì)性的觀察指標(biāo)�����,全面評(píng)價(jià)應(yīng)用納米材料的醫(yī)療器械的安全性和有效性�。
九����、總結(jié)
對(duì)于應(yīng)用納米材料的醫(yī)療器械安全性和有效性評(píng)價(jià),目前仍有許多問題尚未解決��,但已有一些可用的工具�����、手段和標(biāo)準(zhǔn)����,特別是與納米材料安全性測(cè)試相關(guān)的工具,本指導(dǎo)原則已包含這些工具���,申請(qǐng)人在對(duì)應(yīng)用納米材料的醫(yī)療器械安全性和有效性進(jìn)行評(píng)價(jià)時(shí)����,應(yīng)盡可能采用已開發(fā)的新工具���、手段和標(biāo)準(zhǔn)��,并需要注意對(duì)應(yīng)用納米材料的醫(yī)療器械進(jìn)行安全性和有效性評(píng)價(jià)時(shí)考慮一些特殊因素��。
醫(yī)療器械中應(yīng)用的納米材料的潛在風(fēng)險(xiǎn)主要與游離納米材料從器械釋放的可能性����,以及暴露劑量、暴露途徑��、接觸部位和暴露時(shí)間相關(guān)���。潛在釋放取決于納米材料使用方法(在器械中的存在形式)��,如游離納米材料��、固定在表面的納米材料,或內(nèi)嵌在基質(zhì)中的納米材料等�。除納米材料釋放及其潛在效應(yīng)之外,可能的使用部位的局部效應(yīng)也應(yīng)考慮�����。同時(shí)需要注意的是��,即使醫(yī)療器械中不含納米材料,醫(yī)療器械的磨損也可能導(dǎo)致納米尺度顆粒的產(chǎn)生��。此外�����,粒徑大于100 nm的顆粒也存在一定的不同于常規(guī)材料的特性和安全風(fēng)險(xiǎn)���,應(yīng)用這類材料的醫(yī)療器械的安全性評(píng)價(jià)和風(fēng)險(xiǎn)評(píng)估也可參考本指導(dǎo)原則����。
器械在真實(shí)世界環(huán)境中的使用情況可以更好地體現(xiàn)器械的受益風(fēng)險(xiǎn)�����,所以����,在對(duì)應(yīng)用納米材料的醫(yī)療器械做受益風(fēng)險(xiǎn)判定時(shí),申請(qǐng)人和審評(píng)機(jī)構(gòu)可以考慮將收集上市后數(shù)據(jù)作為風(fēng)險(xiǎn)控制措施的有效性方法���。尤其當(dāng)其識(shí)別出了新風(fēng)險(xiǎn)���、確認(rèn)特定的風(fēng)險(xiǎn)已被降低�、識(shí)別出最有可能發(fā)生不良事件的患者����、或者更具體地區(qū)分出不同患者亞組對(duì)器械的響應(yīng),針對(duì)以上情況����,及時(shí)做出應(yīng)對(duì)措施,以降低其風(fēng)險(xiǎn)����。
十、術(shù)語與定義
納米尺度 nanoscale
處于1nm至100nm之間的尺寸范圍�。
注1:本尺寸范圍通常、但非專有地表現(xiàn)出不能由較大尺寸外推得到的特性��。對(duì)于這些特性來說�,尺度上、下限值是近似的����。
注2:本定義中引入下限(約1nm)的目的是為了避免在不設(shè)定下限時(shí)��,單個(gè)或一小簇原子被默認(rèn)為是納米物體或納米結(jié)構(gòu)單元��。
納米材料 nanomaterial
任一外部維度、內(nèi)部或表面結(jié)構(gòu)處于納米尺度的材料���。
注1:本通用術(shù)語包括納米物體和納米結(jié)構(gòu)材料�����。
注2:見工程化的納米材料����、人造納米材料和伴生納米材料�。
注3:近些年隨著科學(xué)界對(duì)納米材料的認(rèn)知逐漸增多,某一維度的尺寸在100nm至1000nm范圍內(nèi)�,且表現(xiàn)出因尺寸而產(chǎn)生的特殊效應(yīng)或現(xiàn)象的材料,該材料在本指導(dǎo)原則評(píng)價(jià)范圍之內(nèi)被認(rèn)為是納米材料��。納米材料的定義根據(jù)最新研究進(jìn)展實(shí)時(shí)更新�����。
工程化的納米材料 engineered nanomaterial
為了特定目的或功能而設(shè)計(jì)的納米材料�����。
人造納米材料 manufactured nanomaterial
為了商業(yè)目的而制造的具有特定功能或特定組成的納米材料。
伴生納米材料 incidental nanomaterial
在某一過程中作為副產(chǎn)品非特意產(chǎn)生的納米材料���。
注1:過程包括制造����、生物技術(shù)或其他過程����。
注2:見ISO/TS 27628: 2007, 2.21對(duì)“超細(xì)顆粒”的定義��。
納米物體 nano-object
一維��、二維或三維外部維度處于納米尺度的物體�。
注:用于所有相互分離的納米尺度物體的通用術(shù)語。
納米顆粒 nanoparticle
三個(gè)維度的外部尺寸都在納米尺度的納米物體�,其最長(zhǎng)軸和最短軸的長(zhǎng)度沒有明顯差別。
注:如果納米物體最長(zhǎng)軸和最短軸的長(zhǎng)度差別顯著(大于3倍)時(shí)����,應(yīng)用納米纖維或納米片來表示納米顆粒。
納米纖維 nanofibre
兩個(gè)維度外部尺寸相近且處于納米尺度��,第三個(gè)維度尺寸特別大的納米物體���。
注1:最長(zhǎng)的外部尺寸可不在納米尺度�。
注2:納米纖維術(shù)語也可用nanofibril和nanofilament。
注3:見納米顆粒注。
納米片 nanoplate
一個(gè)維度外部尺寸在納米尺度���,其他兩個(gè)維度外部尺寸明顯大于最小尺寸的納米物體。
注1:較大外部尺寸不必在納米尺度。
注2:見納米顆粒注�。
納米結(jié)構(gòu) nanostructure
一個(gè)或多個(gè)部分處于納米尺度區(qū)域的相互關(guān)聯(lián)的組成部分�。
注:區(qū)域由性質(zhì)不連續(xù)的邊界來界定。
納米結(jié)構(gòu)材料 nanostructured material
內(nèi)部或表面具有納米結(jié)構(gòu)的材料�����。
注:本定義不排除納米物體具有內(nèi)部或表面納米結(jié)構(gòu)的可能性�����。如果外部維度(一個(gè)或多個(gè))處于納米尺度��,推薦用術(shù)語“納米物體”���。
納米技術(shù)nanotechnology
應(yīng)用科學(xué)知識(shí)操縱和控制納米尺度的物質(zhì)以利用與單個(gè)原子����、分子或塊體材料性質(zhì)顯著不同的、與尺寸和結(jié)構(gòu)相關(guān)的性質(zhì)和現(xiàn)象�����。
注:操縱和控制包括材料合成���。
聚集體 aggregate
強(qiáng)束縛或融合在一起的顆粒構(gòu)成的新顆粒����,其外表面積可能顯著小于其單個(gè)顆粒表面積的總和��。
注1:支持聚集體的力都是強(qiáng)作用力�,如共價(jià)鍵或源于由燒結(jié)或復(fù)雜的物理纏結(jié)。
注2:聚集體也被稱為次級(jí)顆粒�����,而源顆粒則被稱為初級(jí)顆粒��。
團(tuán)聚體 agglomerate
弱束縛顆粒的堆積體��、聚集體或兩者的混合體��,其外表面積與單個(gè)顆粒的表面積總和相近���。
注1:支撐團(tuán)聚體的作用力都是弱力�����,如范德華力或簡(jiǎn)單的物理纏結(jié)���。
注2:團(tuán)聚體也被稱為次級(jí)顆粒,而源顆粒則被稱為初級(jí)顆粒�。
溶解度 solubility
溶質(zhì)在溶劑中的溶解能力。用其在平衡條件下的最大溶解量表示�。如固溶度、溶水度等���。
比表面積 specific surface area
單位質(zhì)量粉末或多孔體具有的總表面積���。
十一、參考文獻(xiàn)
1.歐盟新興與新識(shí)別健康風(fēng)險(xiǎn)委員會(huì)《醫(yī)療器械中應(yīng)用的納米材料潛在健康效應(yīng)指導(dǎo)原則》Guidance on the Determination of Potential Health Effects of Nanomaterials Used in Medical Devices,Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR)2015
2.ISO/TR 10993-22:2017《Biological evaluation of medical devices—Part 22: Guidance on nanomaterials》
3.GB/T 16886.1《醫(yī)療器械生物學(xué)評(píng)價(jià)第1部分:風(fēng)險(xiǎn)管理過程中的評(píng)價(jià)和測(cè)試》
4.YY/T 0993《醫(yī)療器械生物學(xué)評(píng)價(jià)納米材料:體外細(xì)胞毒性試驗(yàn)(MTT試驗(yàn)和LDH試驗(yàn))》
5.YY/T 1295《醫(yī)療器械生物學(xué)評(píng)價(jià)納米材料:細(xì)菌內(nèi)毒素試驗(yàn)》
6.YY/T 1532《醫(yī)療器械生物學(xué)評(píng)價(jià)納米材料溶血試驗(yàn)》
7.YY/T 0316《醫(yī)療器械風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》
8.GB/T 16886.9《醫(yī)療器械生物學(xué)評(píng)價(jià)–第9部分:潛在降解產(chǎn)物的鑒別和定量框架》
9.GB/T 16886.13《醫(yī)療器械生物學(xué)評(píng)價(jià)–第13部分:聚合物醫(yī)療器械降解產(chǎn)物鑒別和定量》
10.GB/T 16886.14《醫(yī)療器械生物學(xué)評(píng)價(jià)–第14部分:陶瓷降解產(chǎn)物的鑒別和定量》
11.GB/T 16886.15《醫(yī)療器械生物學(xué)評(píng)價(jià)–第15部分:金屬和合金降解產(chǎn)物的鑒別和定量》
12.GB/T 16886.18《醫(yī)療器械生物學(xué)評(píng)價(jià)–第18部分:材料化學(xué)表征》
13.GB/T 16886.19《醫(yī)療器械生物學(xué)評(píng)價(jià)–第19部分:材料理化�、形態(tài)學(xué)和形貌學(xué)表征》
14.歐盟員會(huì)建議(2011/696/EU)(EC 2011)
15.《國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械安全和性能的基本原則的通告》(2020年第18號(hào))
16.《醫(yī)療器械動(dòng)物實(shí)驗(yàn)研究技術(shù)審查指導(dǎo)原則第一部分:決策原則》(2019年第18號(hào))
17.《醫(yī)療器械產(chǎn)品受益-風(fēng)險(xiǎn)評(píng)估注冊(cè)技術(shù)審查指導(dǎo)原則》(2019年第79號(hào))
18.《國(guó)家食品藥品監(jiān)督管理總局關(guān)于發(fā)布醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則的通告》(2015年第14號(hào))
19.《醫(yī)療器械注冊(cè)管理辦法》(國(guó)家食品藥品監(jiān)督管理總局令第4號(hào))
20.《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》(國(guó)家食品藥品監(jiān)督管理總局 中華人民共和國(guó)國(guó)家衛(wèi)生和計(jì)劃生育委員會(huì)令第25號(hào))
21.ISO/TR 13014,Nanotechnologies-Guidance on physico -chemical characterization of engineered nanoscale materials for toxicologic assessment
22.GB/T 30544.1《納米科技 術(shù)語 第1部分:核心術(shù)語》
23.GB/T 30544.4《納米科技 術(shù)語 第4部分:納米結(jié)構(gòu)材料》
24.Nanotechnologies in medical devices.RIVM Report 2015-0149
十二、編寫單位
本指導(dǎo)原則由國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心牽頭����,國(guó)家納米科學(xué)中心、廣東粵港澳大灣區(qū)國(guó)家納米科技創(chuàng)新研究院��、中國(guó)食品藥品檢定研究院參與編寫,由國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心負(fù)責(zé)解釋����。