第二類醫(yī)療器械說明書更改告知程序

一����、項(xiàng)目名稱
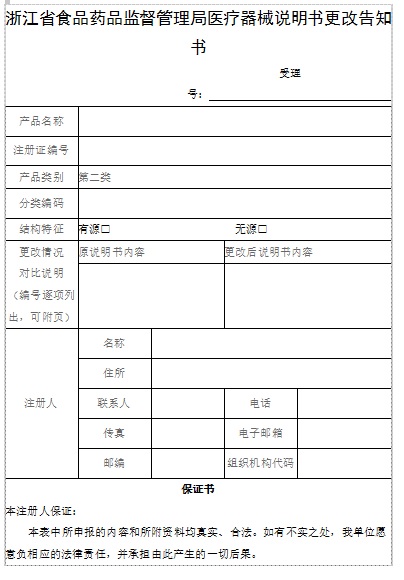
第二類醫(yī)療器械說明書更改告知
二、受理范圍
省內(nèi)第二類已注冊(cè)的醫(yī)療器械���,不屬于注冊(cè)變更范圍內(nèi)的說明書其他內(nèi)容發(fā)生變化的書面告知�。
三�����、收費(fèi)依據(jù)
不收費(fèi)�����。
四��、辦理?xiàng)l件
由注冊(cè)人書面告知���。
五���、資料要求
(一)由注冊(cè)人簽章的醫(yī)療器械說明書更改告知書。
(二)說明書更改情況對(duì)比說明(含更改情況對(duì)比表及變更原因)�。
(三)經(jīng)注冊(cè)審查、備案的說明書的復(fù)印件(與原提交審查時(shí)核定的產(chǎn)品說明書一致)�。
(四)更改后的說明書。
(五)證明性文件:企業(yè)營(yíng)業(yè)執(zhí)照副本復(fù)印件�����、組織機(jī)構(gòu)代碼證復(fù)印件�����、醫(yī)療器械注冊(cè)證及醫(yī)療器械注冊(cè)變更文件復(fù)印件���,且均應(yīng)在有效期內(nèi)��。
(六)具體辦理人應(yīng)提交注冊(cè)人或其代理人授權(quán)書及其身份證復(fù)印件�。
(七)注冊(cè)人提交的資料真實(shí)性的自我保證聲明�����,包括所提交資料的清單以及注冊(cè)人承擔(dān)法律責(zé)任的承諾。
六�����、辦理程序
(一)浙江省食品藥品監(jiān)督管理局受理大廳對(duì)說明書告知資料進(jìn)行形式審查���,對(duì)于符合要求的�����,予以受理���。
(二)受理大廳自受理后,按程序?qū)⑸暾?qǐng)資料移交省醫(yī)療器械審評(píng)中心���。
(三)省醫(yī)療器械審評(píng)中心對(duì)醫(yī)療器械說明書更改情況進(jìn)行審核�,審核同意�����,則相關(guān)材料按程序歸檔�;如不同意,則應(yīng)在收到資料后15個(gè)工作日內(nèi)告知受理大廳�����。
(四)受理大廳依據(jù)醫(yī)療器械審評(píng)中心意見,在5個(gè)工作日內(nèi)制作不予同意通知件�����,并按程序發(fā)放給申請(qǐng)人�����。