根據(jù)《總局辦公廳關(guān)于做好醫(yī)療器械臨床試驗機(jī)構(gòu)備案工作的通知》(食藥監(jiān)辦械管〔2017〕161號)��,“自2019年1月1日起����,醫(yī)療器械(包括體外診斷試劑)臨床試驗申辦者應(yīng)當(dāng)選取已經(jīng)在備案系統(tǒng)備案的醫(yī)療器械臨床試驗機(jī)構(gòu),按照《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》(食品藥品監(jiān)管總局國家衛(wèi)生計生委令第25號)和《體外診斷試劑注冊管理辦法》(食品藥品監(jiān)管總局令第5號)的有關(guān)要求開展臨床試驗����。”��。
引言:《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》自2016年06月01日正式實施����,已將近三年了。但是申辦方在選擇臨床試驗機(jī)構(gòu)和實施執(zhí)行臨床試驗過程中存在著諸多疑問�。在此����,證標(biāo)客為大家簡單介紹如何快速有效地篩選進(jìn)行臨床機(jī)構(gòu)�?
一、醫(yī)療器械臨床試驗機(jī)構(gòu)選擇考慮的幾個主要要素
1�����、國家政策及機(jī)構(gòu)資質(zhì)問題
根據(jù)《總局辦公廳關(guān)于做好醫(yī)療器械臨床試驗機(jī)構(gòu)備案工作的通知》(食藥監(jiān)辦械管〔2017〕161號)�����,自2019年1月1日起�����,醫(yī)療器械(包括體外診斷試劑)臨床試驗申辦者應(yīng)當(dāng)選取已經(jīng)在備案系統(tǒng)備案的醫(yī)療器械臨床試驗機(jī)構(gòu)����,按照《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》(食品藥品監(jiān)管總局國家衛(wèi)生計生委令第25號)和《體外診斷試劑注冊管理辦法》(食品藥品監(jiān)管總局令第5號)的有關(guān)要求開展臨床試驗。有關(guān)單位和個人可登錄備案系統(tǒng)查詢醫(yī)療器械臨床試驗機(jī)構(gòu)備案信息����。
2���、研究者
在篩選主要研究者(PI)時�����,應(yīng)從臨床基地科室名錄中篩選合適的主任醫(yī)生作為主要研究者���,一般為科室主任(或主任級以上醫(yī)生)��;
主要研究者應(yīng)是熟悉臨床藥理的臨床專家�,有醫(yī)療器械臨床試驗的經(jīng)驗���,并具有一定的權(quán)威和專業(yè)影響力���,可協(xié)調(diào)和組織其他單位共同實施臨床試驗。
主要研究者的選擇通?���?梢酝ㄟ^以下幾方面因素參考:
(1)曾與申辦者、CRO公司合作過研究項目的研究者�����;
(2)來自藥監(jiān)管理部門的建議���;
(3)參考臨床研究單位的名單����;
(4)參考學(xué)術(shù)會議摘要;
(5)參考專家?guī)欤?/span>
(6)要有充足的時間保證試驗的實施�,對試驗研究工作感興趣;
同時還應(yīng)確認(rèn)PI是否有正在進(jìn)行相關(guān)項目的研究���,這可能影響研究者的時間精力��,可能導(dǎo)致在開展過程混淆項目資料以及可能影響病例的入組速度�。
3�����、申辦者
申辦者在與臨床基地遴選調(diào)研的過程中���, 除了基本的電話溝通后�����,還依據(jù)實際�,預(yù)約研研究者���,確定好見面時間�。并攜帶樣品�����、詳細(xì)的產(chǎn)品技術(shù)資料(如:研究者手冊(使用說明書)����、方案初稿及其它臨床前的研究資料)上門拜訪。經(jīng)與研究者初步交談后�,應(yīng)定期跟進(jìn)研究者的確認(rèn)情況;
對于臨床試驗經(jīng)費預(yù)算上����,申辦者應(yīng)盡量選擇能夠承受的費用的臨床基地,至于具體費用多少才合適�����,沒有絕對的標(biāo)準(zhǔn)����,由申辦方自己來評估。
4���、其他考慮因素
按照最新的《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》的規(guī)定�,并結(jié)合具體的項目,在開展臨床試驗時��,首先應(yīng)考慮是否需要開展多中心臨床試驗�����;同時還應(yīng)考慮臨床科室的試驗條件能否滿足要求�,例如:是否具備充足的人員,是否配備試驗所需專業(yè)的設(shè)施和條件等因素都應(yīng)加以充分考慮�����。
在臨床試驗管理過程中�����,除CFDA有基本的臨床試驗法規(guī)外�,各省藥監(jiān)部門及部分醫(yī)院在此基礎(chǔ)上還會有一些自己的規(guī)定,對此需要充分了解所選醫(yī)院的臨床試驗管理流程及操作要求之后��,在實際操作過程中才會事半功倍�����。
盡可能就近篩選臨床機(jī)構(gòu),這關(guān)系到:(1)溝通和人力差旅費成本��;(2)監(jiān)查的便利性�;(3)病例收集的難易程度��、試驗費用等�。
最后還要考慮科室的配合度,這一點十分重要�����。如果是通過院領(lǐng)導(dǎo)或臨床試驗機(jī)構(gòu)主管部門讓科室接下這項目�����,有必要再去問問具體開展科室的主任���。因為試驗的執(zhí)行部門是科室�����,如果科室意愿不大���,很可能導(dǎo)致項目延遲����。因此與具體開展科室取得良好溝通配合��,至關(guān)重要���!
二�����、醫(yī)療器械臨床試驗機(jī)構(gòu)選擇方法工具
1�、醫(yī)療器械臨床試驗申辦者可以登錄備案系統(tǒng)選擇已經(jīng)備案的醫(yī)療器械臨床試驗機(jī)構(gòu)開展臨床試驗�。”下面附醫(yī)療器械臨床試驗機(jī)構(gòu)備案信息查詢鏈接:
醫(yī)療器械臨床試驗機(jī)構(gòu)備案管理信息系統(tǒng)網(wǎng)址:http://218.240.145.213:9000/CTMDS/apps/pub/public.jsp
如下圖:
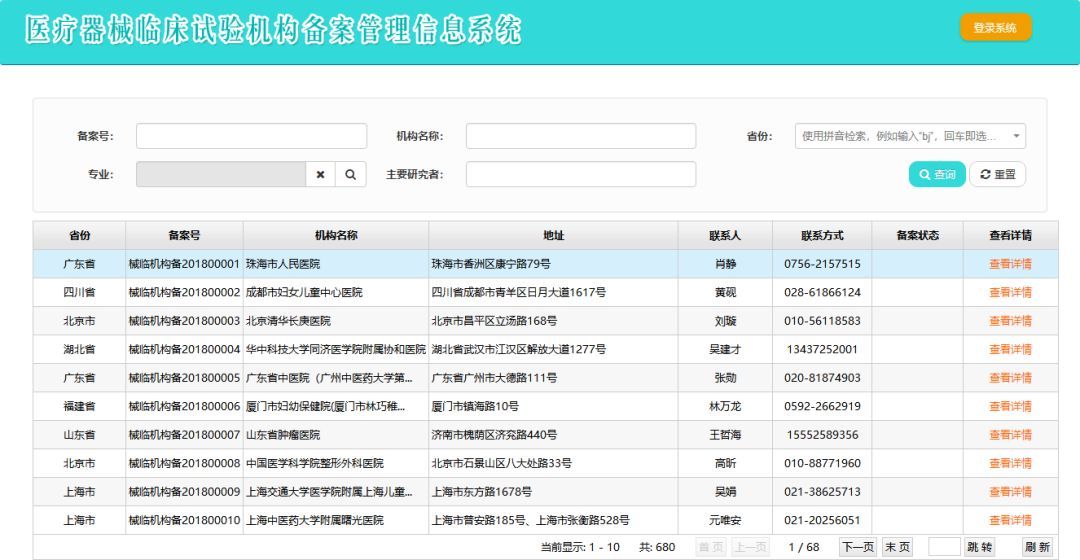
可以根據(jù)需要的省份查��,也可以搜索專業(yè)查�����,也可以根據(jù)主要研究者查����,或者搜索機(jī)構(gòu)名稱查。
2、選擇醫(yī)療器械臨床試驗機(jī)構(gòu)的特殊要求
有關(guān)“特殊要求”�����,怎么查呢��?點擊“查看詳情”��,就能查到醫(yī)療機(jī)構(gòu)的級別信息�����。但是���,主要研究者的項目經(jīng)驗方面,還需要找擬選定的臨床研究機(jī)構(gòu)具體確定是否滿足要求���。

關(guān)于“特殊要求”�����,附法規(guī)原文:
《醫(yī)療器械臨床試驗機(jī)構(gòu)條件和備案管理辦法》規(guī)定備案條件�����,明確了醫(yī)療機(jī)構(gòu)備案應(yīng)當(dāng)具備的條件等相關(guān)要求���;為了加強(qiáng)對高風(fēng)險醫(yī)療器械管理����,保證受試者安全和提高臨床試驗質(zhì)量���,規(guī)定對列入需進(jìn)行臨床試驗審批目錄的第三類產(chǎn)品�����,應(yīng)當(dāng)在三級甲等醫(yī)療機(jī)構(gòu)專業(yè)范圍內(nèi)開展臨床試驗����;規(guī)定開展創(chuàng)新醫(yī)療器械產(chǎn)品或需進(jìn)行臨床試驗審批的第三類醫(yī)療器械產(chǎn)品臨床試驗的主要研究者應(yīng)具有高級技術(shù)職稱并且參加過3個以上醫(yī)療器械或藥物臨床試驗等等����。
3、研究者的學(xué)術(shù)地位�����,可以登錄醫(yī)院官網(wǎng)查詢PI主要研究領(lǐng)域及方向�����。最好可以直接聯(lián)系相關(guān)科室主任詢問合作意向,相關(guān)操作經(jīng)驗��,病例入組速度����,以及費用情況等。
4��、臨床機(jī)構(gòu)辦公室的聯(lián)系信息等�,可以登錄醫(yī)院官網(wǎng)查詢醫(yī)院的機(jī)構(gòu)辦聯(lián)系方式。