對醫(yī)療器械CE認(rèn)證而言�,制造商及其義務(wù)是最核心的事項�。多數(shù)企業(yè)首次接觸醫(yī)療器械CE認(rèn)證,多是第三方機構(gòu)代辦�,加上I類自我宣稱方式,企業(yè)其應(yīng)有的責(zé)任和義務(wù)往往疏于了解�,而這些內(nèi)容對企業(yè)經(jīng)營風(fēng)險防控又極其重要。
引言:對醫(yī)療器械CE認(rèn)證而言�,制造商及其義務(wù)是最核心的事項。多數(shù)企業(yè)首次接觸醫(yī)療器械CE認(rèn)證�,多是第三方機構(gòu)代辦,加上I類自我宣稱方式��,企業(yè)其應(yīng)有的責(zé)任和義務(wù)往往疏于了解�����,而這些內(nèi)容對企業(yè)經(jīng)營風(fēng)險防控又極其重要。
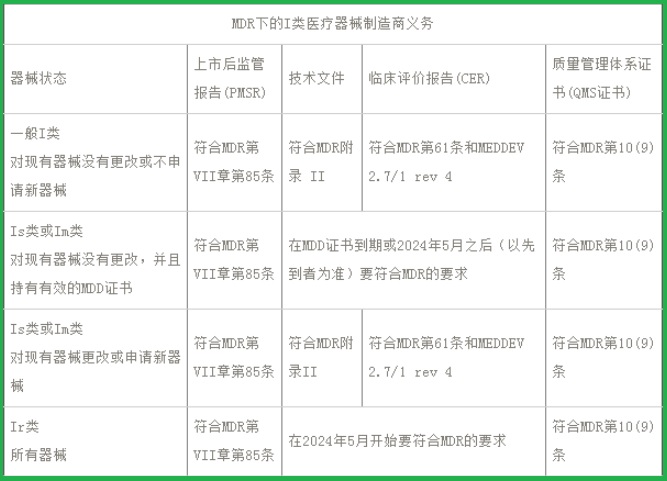
I類醫(yī)療器械CE認(rèn)證(MDR)之制造商義務(wù):
(一)I類器械的PMSR
如果您是I類器械的制造商�����,即使您不打算在短期內(nèi)對I類器械做任何變更���,并將繼續(xù)聲明符合MDD���,您也需要按照歐盟MDR第85條的規(guī)定,建立PMS計劃和生成PMSR報告����。PMSR要包括器械的整個生命周期,需要總結(jié)PMS數(shù)據(jù)的結(jié)果和結(jié)論���,以及對市場上產(chǎn)品采取的任何糾正措施的依據(jù)和說明�。必要時����,應(yīng)對該報告進(jìn)行更新,且如果主管當(dāng)局要求應(yīng)及時提供���。
(二)I類器械的技術(shù)文件
MDR的附錄II要求所有醫(yī)療器械制造商都建立完整的技術(shù)文件��,其中包括申報產(chǎn)品���、前代產(chǎn)品和類似產(chǎn)品的詳細(xì)信息�,申報產(chǎn)品的完整標(biāo)簽信息�����,設(shè)計和制造信息���,基本安全和性能要求�����,收益風(fēng)險分析和風(fēng)險管理信息,產(chǎn)品驗證和確認(rèn)數(shù)據(jù)�����,臨床數(shù)據(jù)等��。
如果對I類無菌和I類帶測量功能器械不進(jìn)行任何變更并且仍持有有效的MDD證書�,則暫時無需按照MDR更新技術(shù)文件,所有通過自我宣稱途徑的可重復(fù)使用的手術(shù)器械也是如此�。但是�����,如果您要銷售任何新的I類器械����,或者對已有器械的設(shè)計或預(yù)期用途進(jìn)行變更��,則必須按照MDR附錄II的要求建立技術(shù)文件�。
(三)I類器械的CER
如果是I類無菌和I類帶測量功能的器械,您可能已經(jīng)具有符合MDD的技術(shù)文件�����。但是根據(jù)通常情況�,MDD下I類醫(yī)療器械的CER基本不會符合MDR的要求。公告機構(gòu)可能不會接受單純的歷史數(shù)據(jù)��,尤其僅僅是沒有不良事件的歷史數(shù)據(jù)�。所以現(xiàn)在就要開始計劃“主動”的收集臨床數(shù)據(jù)為將來做好準(zhǔn)備。
(四)I類制造商的QMS
ISO 13485:2016質(zhì)量體系標(biāo)準(zhǔn)目前在中國貫徹的還是比較好的���,還是有很多I類自我宣稱的醫(yī)療器械生產(chǎn)商都按照該標(biāo)準(zhǔn)建立了質(zhì)量管理體系且都獲得了認(rèn)證��。如果您的企業(yè)還沒有的話����,那我們建議您要抓緊時間了。MDR第10條明確提出了企業(yè)建立質(zhì)量管理體系的要求�,且獲得ISO13485證書是最簡單的證明符合法規(guī)的方式。在建立質(zhì)量管理體系的時候不要忘記MDR的法規(guī)要求��,包括但不僅限于制定法規(guī)符合性負(fù)責(zé)人���,建立警戒系統(tǒng)程序等�。
(五)在EUDAMED中注冊您的公司
歐盟委員會于2020年12月開放了EUDAMED在線數(shù)據(jù)庫�,您需要在EUDAMED數(shù)據(jù)庫中注冊您的公司和器械。即使您不提交新的MDR注冊��,最好也是先獲得單一注冊號(SRN)���,并熟悉該系統(tǒng)�,因為后續(xù)的證書和符合性聲明都需要列明SRN��。