昨日(2022年6月30日),國(guó)家藥監(jiān)局發(fā)布《支持港澳醫(yī)療器械注冊(cè)人在大灣區(qū)內(nèi)地9市生產(chǎn)醫(yī)療器械實(shí)施方案》藥監(jiān)綜藥注〔2022〕61號(hào)�,文件可稱為“港澳醫(yī)療器械注冊(cè)人跨境委托生產(chǎn)實(shí)施方案”,方案的出臺(tái)���,對(duì)原有港澳進(jìn)口醫(yī)療器械注冊(cè)路徑是一個(gè)大的變化�,也為境外醫(yī)療器械進(jìn)入內(nèi)地市場(chǎng)提供了一條新路�。
昨日(2022年6月30日),國(guó)家藥監(jiān)局發(fā)布《支持港澳醫(yī)療器械注冊(cè)人在大灣區(qū)內(nèi)地9市生產(chǎn)醫(yī)療器械實(shí)施方案》藥監(jiān)綜藥注〔2022〕61號(hào)����,文件可稱為“港澳醫(yī)療器械注冊(cè)人跨境委托生產(chǎn)實(shí)施方案”,方案的出臺(tái)�,對(duì)原有港澳進(jìn)口醫(yī)療器械注冊(cè)路徑是一個(gè)大的變化,也為境外醫(yī)療器械進(jìn)入內(nèi)地市場(chǎng)提供了一條新路�����。
支持港澳醫(yī)療器械注冊(cè)人在大灣區(qū)內(nèi)地9市生產(chǎn)醫(yī)療器械實(shí)施方案
為貫徹落實(shí)《粵港澳大灣區(qū)藥品醫(yī)療器械監(jiān)管創(chuàng)新發(fā)展工作方案》中“在粵港澳大灣區(qū)開展醫(yī)療器械注冊(cè)人制度改革”有關(guān)要求�,支持港澳醫(yī)療器械注冊(cè)人將持有的醫(yī)療器械在粵港澳大灣區(qū)內(nèi)地9市符合條件的企業(yè)生產(chǎn)(以下簡(jiǎn)稱“港澳醫(yī)療器械注冊(cè)人 跨境委托生產(chǎn)”)。經(jīng)研究�,制定工作方案如下:
一�����、工作目標(biāo)
以習(xí)近平新時(shí)代中國(guó)特色社會(huì)主義思想為指導(dǎo),深入貫徹落實(shí)習(xí)近平總書記關(guān)于粵港澳大灣區(qū)建設(shè)的重要指示精神和要求����,按照黨中央、國(guó)務(wù)院決策部署和市場(chǎng)監(jiān)管總局等8部門印發(fā)《粵港澳大灣區(qū)藥品醫(yī)療器械監(jiān)管創(chuàng)新發(fā)展工作方案》有關(guān)規(guī)定�,深化醫(yī)療器械注冊(cè)人改革,允許港澳醫(yī)療器械注冊(cè)人跨境委托生產(chǎn)����,進(jìn)一步推動(dòng)粵港澳大灣區(qū)生物醫(yī)藥產(chǎn)業(yè)深度融合,實(shí)現(xiàn)粵港澳大灣區(qū)醫(yī)藥產(chǎn)業(yè)共同發(fā)展���。
二��、職責(zé)分工
國(guó)家藥監(jiān)局負(fù)責(zé)對(duì)港澳醫(yī)療器械注冊(cè)證變更實(shí)施審批��。
廣東省藥監(jiān)局負(fù)責(zé)港澳醫(yī)療器械注冊(cè)人跨境委托生產(chǎn)涉及的醫(yī)療器械生產(chǎn)許可工作����,以及組織開展醫(yī)療器械注冊(cè)質(zhì)量管理體系核查����,并落實(shí)屬地監(jiān)管責(zé)任,加強(qiáng)對(duì)轄區(qū)內(nèi)相關(guān)企業(yè)的監(jiān)督檢查���。
三����、適用范圍
(一)品種范圍:適用于在香港特別行政區(qū)或澳門特別行政區(qū)合法登記的企業(yè)所持有和生產(chǎn),并已獲得《醫(yī)療器械注冊(cè)證》在境內(nèi)注冊(cè)上市的醫(yī)療器械�。《禁止委托生產(chǎn)醫(yī)療器械目錄》(國(guó)家藥監(jiān)局通告2022年第17號(hào))規(guī)定的品種除外�。
(二)適用企業(yè):醫(yī)療器械注冊(cè)人為港澳企業(yè)的,由其在大灣區(qū)內(nèi)地設(shè)立的外商投資企業(yè)法人作為代理人����,辦理醫(yī)療器械變更注冊(cè)事項(xiàng),協(xié)助港澳醫(yī)療器械注冊(cè)人履行義務(wù)�����,承擔(dān)連帶責(zé)任�。
港澳醫(yī)療器械注冊(cè)人獲得國(guó)家藥監(jiān)局發(fā)放的醫(yī)療器械注冊(cè)證后,可以委托大灣區(qū)內(nèi)地9市符合條件的企業(yè)生產(chǎn)���。受托生產(chǎn)企業(yè)應(yīng)當(dāng)具備與所生產(chǎn)醫(yī)療器械相適應(yīng)的質(zhì)量管理體系和生產(chǎn)能力���。
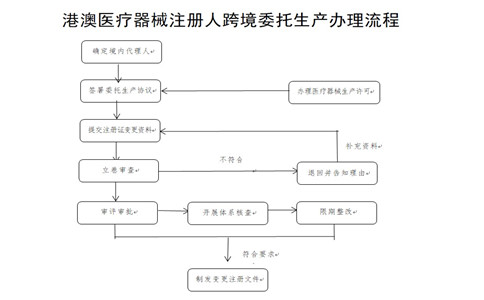
四、工作程序
(一)確定境內(nèi)代理人�����。港澳醫(yī)療器械注冊(cè)人由其在大灣區(qū)內(nèi)地設(shè)立的外商投資企業(yè)法人作為代理人�����,辦理醫(yī)療器械變更注冊(cè)事項(xiàng)�,協(xié)助港澳醫(yī)療器械注冊(cè)人履行《醫(yī)療器械監(jiān)督管理?xiàng)l例》第二十條義務(wù),承擔(dān)連帶責(zé)任�。該代理人應(yīng)與港澳醫(yī)療器械注冊(cè)人所持有醫(yī)療器械注冊(cè)證登載的代理人一致。
(二)簽署委托生產(chǎn)協(xié)議����。港澳醫(yī)療器械注冊(cè)人在粵港澳大灣區(qū)內(nèi)地9市選擇符合條件的企業(yè)作為受托生產(chǎn)企業(yè),參考國(guó)家藥監(jiān)局制定的醫(yī)療器械委托生產(chǎn)質(zhì)量協(xié)議指南要求��,由港澳醫(yī)療器械注冊(cè)人���、代理人和受托生產(chǎn)企業(yè)三方共同簽訂質(zhì)量協(xié)議以及委托協(xié)議���,監(jiān)督受托生產(chǎn)企業(yè)履行有關(guān)協(xié)議約定的義務(wù)。
(三)變更醫(yī)療器械注冊(cè)證生產(chǎn)地址��。代理人協(xié)助港澳醫(yī)療器械注冊(cè)人向國(guó)家藥監(jiān)局提交符合要求的申請(qǐng)材料�����。國(guó)家藥監(jiān)局器審中心按照程序開展審評(píng)審批工作。廣東省藥監(jiān)局按照醫(yī)療器械注冊(cè)質(zhì)量體系核查有關(guān)要求�、生產(chǎn)質(zhì)量管理規(guī)范及其附錄的要求組織開展現(xiàn)場(chǎng)體系核查。經(jīng)技術(shù)審評(píng)及注冊(cè)質(zhì)量體系核查�,符合要求的,準(zhǔn)予變更注冊(cè)���,發(fā)放《醫(yī)療器械變更注冊(cè)文件》���,載明受托生產(chǎn)企業(yè)名稱、生產(chǎn)地址及原注冊(cè)證號(hào)等信息�����。
(四)受托生產(chǎn)企業(yè)履行報(bào)告義務(wù)���。港澳醫(yī)療器械注冊(cè)人完成醫(yī)療器械注冊(cè)證變更后��,受托生產(chǎn)企業(yè)應(yīng)當(dāng)向廣東省藥監(jiān)局報(bào)告增加生產(chǎn)產(chǎn)品品種�,并提供委托方�����、受托生產(chǎn)產(chǎn)品、受托期限等信息����。
五����、申報(bào)資料
按照《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》(國(guó)家藥監(jiān)局公告2021年第121號(hào))和《關(guān)于公布體外診斷試劑注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》(國(guó)家藥監(jiān)局公告2021年第122號(hào))有關(guān)要求提交變更注冊(cè)申報(bào)資料。
六���、實(shí)施依據(jù)
《醫(yī)療器械監(jiān)督管理?xiàng)l例》《醫(yī)療器械注冊(cè)與備案管理辦法》《體外診斷試劑注冊(cè)與備案管理辦法》《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》《粵港澳大灣區(qū)藥品醫(yī)療器械監(jiān)管創(chuàng)新發(fā)展工作方案》等�����。
七���、注冊(cè)收費(fèi)
醫(yī)療器械注冊(cè)收費(fèi)標(biāo)準(zhǔn)按照《國(guó)家食品藥品監(jiān)督管理總局關(guān)于發(fā)布藥品、醫(yī)療器械產(chǎn)品注冊(cè)收費(fèi)標(biāo)準(zhǔn)的公告》(2015年53號(hào))要求執(zhí)行�����。
八�、工作要求
(一)港澳醫(yī)療器械注冊(cè)人跨境委托生產(chǎn)的醫(yī)療器械,原則上應(yīng)當(dāng)與醫(yī)療器械注冊(cè)證及其附件載明的相關(guān)事項(xiàng)保持一致�,其主要原材料和生產(chǎn)工藝不應(yīng)發(fā)生改變����,產(chǎn)品在境內(nèi)生產(chǎn)的質(zhì)量管理體系應(yīng)當(dāng)與境外生產(chǎn)質(zhì)量管理體系具有等同性�����。
(二)港澳醫(yī)療器械注冊(cè)人應(yīng)當(dāng)嚴(yán)格落實(shí)醫(yī)療器械全生命周期質(zhì)量管理主體責(zé)任�����,按照《醫(yī)療器械監(jiān)督管理?xiàng)l例》《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》等要求�,建立健全質(zhì)量管理體系并保證有效運(yùn)行,切實(shí)履行全過(guò)程質(zhì)量管理�����、不良事件監(jiān)測(cè)及產(chǎn)品召回等義務(wù)�。
(三)港澳醫(yī)療器械注冊(cè)人在大灣區(qū)內(nèi)地9市的生產(chǎn)經(jīng)營(yíng)行為違反《醫(yī)療器械監(jiān)督管理?xiàng)l例》及配套規(guī)章制度的,注冊(cè)人承擔(dān)主體責(zé)任��,代理人承擔(dān)連帶責(zé)任�,受托生產(chǎn)企業(yè)承擔(dān)相應(yīng)法律責(zé)任。港澳醫(yī)療器械注冊(cè)人�����、代理人應(yīng)當(dāng)每年對(duì)質(zhì)量管理體系的運(yùn)行情況進(jìn)行自查,并于次年3月31日前通過(guò)省藥監(jiān)局網(wǎng)上平臺(tái)提交自查報(bào)告��。
(四)廣東省藥監(jiān)局按照“問(wèn)題導(dǎo)向���,防范風(fēng)險(xiǎn)�,責(zé)任明晰”的原則����,創(chuàng)新醫(yī)療器械監(jiān)管方式�,與港澳監(jiān)管部門探索建立信息暢通、銜接有序��、協(xié)作有力的監(jiān)管工作機(jī)制�,完善事中事后監(jiān)管體系,增強(qiáng)監(jiān)管合力����。夯實(shí)港澳注冊(cè)人醫(yī)療器械全生命周期質(zhì)量管理責(zé)任,監(jiān)督代理人對(duì)研制��、生產(chǎn)���、經(jīng)營(yíng)�����、使用全過(guò)程中醫(yī)療器械的安全性�、有效性依法承擔(dān)連帶責(zé)任,加強(qiáng)對(duì)受托生產(chǎn)企業(yè)相關(guān)生產(chǎn)活動(dòng)的監(jiān)督檢查�����,加強(qiáng)相關(guān)產(chǎn)品質(zhì)量抽檢和不良事件監(jiān)測(cè)工作�����,提升分析預(yù)警能力����,切實(shí)防范醫(yī)療器械安全風(fēng)險(xiǎn)。
九���、其他事項(xiàng)
(一)港澳醫(yī)療器械注冊(cè)人可以在大灣區(qū)內(nèi)地9市符合條件的多家企業(yè)進(jìn)行委托生產(chǎn)��,辦理程序同上��。
(二)港澳醫(yī)療器械注冊(cè)人解除跨境委托生產(chǎn)的���,原受托生產(chǎn)企業(yè)應(yīng)當(dāng)在30日內(nèi)向廣東省藥監(jiān)局報(bào)告��。
(三)關(guān)于港澳醫(yī)療器械注冊(cè)人委托生產(chǎn)的醫(yī)療器械上市銷售問(wèn)題����,由廣東省藥監(jiān)局牽頭與海關(guān)��、稅務(wù)����、外匯管理等部門溝通,協(xié)助企業(yè)實(shí)施依法合規(guī)的便捷跨境結(jié)算方式���。
標(biāo)簽:港澳醫(yī)療器械注冊(cè)人跨境委托生產(chǎn)辦理流程