引言:近日���,藥監(jiān)總局發(fā)布2019年度醫(yī)療器械注冊工作報告��,報告中包括了哪些重要信息��?一起來了解��。

2019年度醫(yī)療器械注冊工作報告
2019年�,國家藥監(jiān)局以習(xí)近平新時代中國特色社會主義思想為指導(dǎo),全面貫徹“四個最嚴(yán)”要求����,以保護(hù)和促進(jìn)公眾用械安全為使命,持續(xù)深化醫(yī)療器械審評審批制度改革�����,推動監(jiān)管科學(xué)研究�����,堅(jiān)持風(fēng)險管理���,強(qiáng)化責(zé)任落實(shí)�����,推進(jìn)智慧監(jiān)管�,著力提升醫(yī)療器械注冊審評審批的質(zhì)量與效率��。
一、醫(yī)療器械注冊工作情況
?�。ㄒ唬┽t(yī)療器械法規(guī)體系進(jìn)一步完善
1.積極推進(jìn)醫(yī)療器械監(jiān)督管理?xiàng)l例修訂����。配合司法部開展重點(diǎn)問題實(shí)地調(diào)研并對條例進(jìn)一步修改完善,同步啟動配套規(guī)章����、規(guī)范性文件的制修訂。
2.發(fā)布《定制式醫(yī)療器械監(jiān)督管理規(guī)定(試行)》(2019年第53號公告)����。明確定制式醫(yī)療器械的定義���、備案����、設(shè)計����、加工、使用��、監(jiān)督管理等方面要求,進(jìn)一步鼓勵定制式醫(yī)療器械的創(chuàng)新研發(fā)�,滿足臨床罕見個性化需求。
3.持續(xù)推進(jìn)醫(yī)療器械技術(shù)審查指導(dǎo)原則制修訂��。發(fā)布《醫(yī)療器械附條件批準(zhǔn)上市指導(dǎo)原則》等57項(xiàng)醫(yī)療器械技術(shù)審查指導(dǎo)原則��,統(tǒng)一審查尺度����,提升各級藥品監(jiān)管部門審查水平。
?�。ǘ┽t(yī)療器械審評審批制度改革持續(xù)深入
1.優(yōu)化臨床試驗(yàn)審批����。發(fā)布《關(guān)于調(diào)整醫(yī)療器械臨床試驗(yàn)審批程序的公告》(2019年第26號公告),進(jìn)一步優(yōu)化臨床試驗(yàn)審批程序���,由“明示”許可調(diào)整為“默示”許可��。
2.繼續(xù)擴(kuò)大免于進(jìn)行臨床試驗(yàn)醫(yī)療器械目錄�����。發(fā)布《關(guān)于公布新增和修訂的免于進(jìn)行臨床試驗(yàn)醫(yī)療器械目錄的通告》(2019年第91號公告)��,新增148項(xiàng)醫(yī)療器械產(chǎn)品和23項(xiàng)體外診斷試劑產(chǎn)品免于進(jìn)行臨床試驗(yàn)�,對48項(xiàng)醫(yī)療器械產(chǎn)品和4項(xiàng)體外診斷試劑產(chǎn)品名稱和描述進(jìn)行了修訂。目前免于進(jìn)行臨床試驗(yàn)醫(yī)療器械目錄包含1003項(xiàng)���,體外診斷試劑目錄包含416項(xiàng)�����,合計達(dá)到1419項(xiàng)����。
3.持續(xù)做好創(chuàng)新醫(yī)療器械審批工作�。2019年共有36個創(chuàng)新產(chǎn)品和12個優(yōu)先審批產(chǎn)品進(jìn)入“綠色通道”。批準(zhǔn)正電子發(fā)射斷層掃描及磁共振成像系統(tǒng)等19個創(chuàng)新醫(yī)療器械����,中空纖維膜血液透析濾過器等10項(xiàng)優(yōu)先產(chǎn)品上市����,促進(jìn)醫(yī)療器械產(chǎn)業(yè)創(chuàng)新發(fā)展,滿足人民群眾使用高水平醫(yī)療器械需要����。
4.擴(kuò)大醫(yī)療器械注冊人制度試點(diǎn)��。印發(fā)《國家藥監(jiān)局關(guān)于擴(kuò)大醫(yī)療器械注冊人制度試點(diǎn)工作的通知》�����,將醫(yī)療器械注冊人制度試點(diǎn)推至北京���、江蘇、浙江等21個省�、自治區(qū)和直轄市。2019年共有22家企業(yè)的93個產(chǎn)品按照注冊人制度試點(diǎn)獲批�,其中包括跨省委托生產(chǎn)和第三類醫(yī)療器械通過注冊人制度委托生產(chǎn)等不同情況。進(jìn)一步釋放醫(yī)療器械注冊人制度紅利�,鼓勵醫(yī)療器械創(chuàng)新,落實(shí)主體責(zé)任����,為全面實(shí)施醫(yī)療器械注冊人制度提供重要支撐。
?�。ㄈ┽t(yī)療器械基礎(chǔ)工作不斷夯實(shí)
1.醫(yī)療器械標(biāo)準(zhǔn)體系進(jìn)一步健全���。2019年���,國家藥監(jiān)局下達(dá)108項(xiàng)標(biāo)準(zhǔn)制修訂項(xiàng)目����,其中國家標(biāo)準(zhǔn)15項(xiàng)��、行業(yè)標(biāo)準(zhǔn)93項(xiàng)�。發(fā)布行業(yè)標(biāo)準(zhǔn)72項(xiàng)。截止2019年底����,醫(yī)療器械現(xiàn)行有效標(biāo)準(zhǔn)共1671項(xiàng),其中國家標(biāo)準(zhǔn)220項(xiàng)���,行業(yè)標(biāo)準(zhǔn)1451項(xiàng)�,我國標(biāo)準(zhǔn)與國際標(biāo)準(zhǔn)一致性程度達(dá)到90.4%���。
2.分類和命名工作持續(xù)完善���。優(yōu)化藥械組合產(chǎn)品屬性界定工作,發(fā)布《關(guān)于調(diào)整藥械組合產(chǎn)品屬性界定有關(guān)事項(xiàng)的通告》�。制定分類目錄動態(tài)調(diào)整工作程序。分3批公布1073項(xiàng)分類界定結(jié)果�,指導(dǎo)各方精準(zhǔn)分類。發(fā)布《醫(yī)療器械通用名稱命名指導(dǎo)原則》����,進(jìn)一步規(guī)范醫(yī)療器械通用名稱。
?����。ㄋ模┽t(yī)療器械智慧監(jiān)管初見成效
1.推進(jìn)注冊電子申報�����。印發(fā)《關(guān)于實(shí)施醫(yī)療器械注冊電子申報的公告》��,建立注冊電子申報信息系統(tǒng)(eRPS)���,實(shí)現(xiàn)注冊申報網(wǎng)上辦理���。2019年,共有7512項(xiàng)注冊申請通過線上提交��。
2.開展立卷審查���。實(shí)現(xiàn)審評項(xiàng)目智能分配���,簡單項(xiàng)目和復(fù)雜項(xiàng)目分級審評��,首次注冊�、復(fù)雜變更和臨床試驗(yàn)審批立卷審查��,以臨床為導(dǎo)向的分段審評制度和復(fù)雜項(xiàng)目管理人制度逐步建立��。
3.實(shí)施醫(yī)療器械唯一標(biāo)識�。印發(fā)《醫(yī)療器械唯一標(biāo)識系統(tǒng)規(guī)則》和相關(guān)標(biāo)準(zhǔn),完成醫(yī)療器械唯一標(biāo)識數(shù)據(jù)庫一期工程建設(shè)���,賦予產(chǎn)品“電子身份證”�����。強(qiáng)化源頭賦碼���,探索從源頭生產(chǎn)到臨床使用全鏈條聯(lián)動。會同國家衛(wèi)生健康委印發(fā)《醫(yī)療器械唯一標(biāo)識系統(tǒng)試點(diǎn)工作方案》�,聯(lián)合開展試點(diǎn)。發(fā)布第一批醫(yī)療器械唯一標(biāo)識工作有關(guān)事項(xiàng)的通告��,明確品種范圍�、進(jìn)度安排和工作要求��,分步推動醫(yī)療器械唯一標(biāo)識工作有序開展����。
?��。ㄎ澹┡R床試驗(yàn)和注冊資料管理繼續(xù)加強(qiáng)
1.繼續(xù)開展醫(yī)療器械臨床試驗(yàn)監(jiān)督檢查。分2批對20個醫(yī)療器械臨床試驗(yàn)項(xiàng)目進(jìn)行監(jiān)督檢查�,對16個注冊項(xiàng)目開展臨床試驗(yàn)樣本真實(shí)性延伸核查。
2.積極推動醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)備案���。截止2019年底�,全國已有839家臨床試驗(yàn)機(jī)構(gòu)備案�。對管理者、項(xiàng)目負(fù)責(zé)人和臨床試驗(yàn)技術(shù)人員開展三期培訓(xùn)�����。
3.嚴(yán)厲打擊提供虛假注冊資料注冊行為�����。根據(jù)相關(guān)線索組織對深圳萊福百泰醫(yī)療科技有限公司開展核查�����,對深圳萊福百泰醫(yī)療科技有限公司所提交的電子上消化道內(nèi)窺鏡和電子下消化道內(nèi)窺鏡兩個產(chǎn)品不予注冊。
?�。┍O(jiān)管科學(xué)研究穩(wěn)步推進(jìn)
1.積極推進(jìn)監(jiān)管科學(xué)研究���。啟動中國藥品監(jiān)管科學(xué)行動計劃�。首批啟動項(xiàng)目包括藥械組合產(chǎn)品技術(shù)評價研究��、人工智能醫(yī)療器械安全有效性評價研究�����、醫(yī)療器械新材料監(jiān)管科學(xué)研究���、真實(shí)世界數(shù)據(jù)用于醫(yī)療器械臨床評價的方法學(xué)研究等項(xiàng)目��。在四川大學(xué)�����、華南理工大學(xué)設(shè)立國家局監(jiān)管科學(xué)研究基地���,推動醫(yī)療器械監(jiān)管科學(xué)研究工作��。
2.推動醫(yī)療器械臨床真實(shí)世界數(shù)據(jù)應(yīng)用試點(diǎn)��。結(jié)合監(jiān)管科學(xué)行動計劃項(xiàng)目���,推動臨床真實(shí)世界數(shù)據(jù)應(yīng)用試點(diǎn)��,依托重點(diǎn)地區(qū)����,制定試點(diǎn)方案,確定試點(diǎn)產(chǎn)品�����,制定《真實(shí)世界數(shù)據(jù)用于醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》��。
?。ㄆ撸﹪H交流合作取得實(shí)效
1.國際交流成果豐碩。參加國際醫(yī)療器械監(jiān)管機(jī)構(gòu)論壇(IMDRF)第16次管理委員會會議�,經(jīng)IMDRF成員國一致同意,會議批準(zhǔn)我國牽頭的臨床評價工作組“臨床證據(jù)–關(guān)鍵定義和概念”“臨床評價”“臨床研究”三份指南文件�,這是自中國加入IMDRF后第一次由中國藥品監(jiān)管機(jī)構(gòu)牽頭組織編寫的指南文件。管理委員會同時贊成中國牽頭的工作組提出的“上市后臨床隨訪研究”擴(kuò)展項(xiàng)目立項(xiàng)����。管理委員會一致同意中國加入國家監(jiān)管機(jī)構(gòu)報告信息交流機(jī)制���,與成員國共同分享醫(yī)療器械產(chǎn)品相關(guān)安全信息,共同應(yīng)對全球醫(yī)療器械風(fēng)險挑戰(zhàn)�。此外,中國作為標(biāo)準(zhǔn)工作組聯(lián)席主席國�,在本次會議上派代表向管理委員會和業(yè)界介紹了標(biāo)準(zhǔn)工作組工作進(jìn)展,研究成果《標(biāo)準(zhǔn)認(rèn)可和使用情況分析報告》和《認(rèn)可標(biāo)準(zhǔn)清單》經(jīng)管理委員會全體成員一致同意通過�。
2.參加第24屆亞洲醫(yī)療器械法規(guī)協(xié)調(diào)會(AHWP)年會。作為AHWP副主席和兩個工作組主席���,介紹中國醫(yī)療器械注冊和監(jiān)管體系最新進(jìn)展���,主持工作組工作討論和法規(guī)協(xié)調(diào)工作,充分發(fā)揮我國在區(qū)域醫(yī)療器械監(jiān)管中的作用����,積極推進(jìn)亞洲法規(guī)協(xié)調(diào)工作。
二�����、醫(yī)療器械注冊申請受理情況
2019年,國家藥監(jiān)局依職責(zé)共受理醫(yī)療器械首次注冊�����、延續(xù)注冊和許可事項(xiàng)變更注冊申請9104項(xiàng)��,與2018年相比注冊受理項(xiàng)目增加37.8%����。
(一)整體情況
受理境內(nèi)第三類醫(yī)療器械注冊申請3511項(xiàng)���,受理進(jìn)口醫(yī)療器械注冊申請5593項(xiàng)。
按注冊品種區(qū)分�����,醫(yī)療器械注冊申請5877項(xiàng)����,體外診斷試劑注冊申請3227項(xiàng)。
按注冊形式區(qū)分�����,首次注冊申請1693項(xiàng),占全部醫(yī)療器械注冊申請的18.6%����;延續(xù)注冊申請5081項(xiàng),占全部醫(yī)療器械注冊申請的55.8%���;許可事項(xiàng)變更注冊申請2330項(xiàng)�,占全部醫(yī)療器械注冊申請的25.6%��。注冊形式比例情況見圖1�。

(二)分項(xiàng)情況
1.境內(nèi)第三類醫(yī)療器械注冊受理情況
境內(nèi)第三類醫(yī)療器械注冊受理共3511項(xiàng),與2018年相比大幅增加47.4%��。其中��,醫(yī)療器械注冊申請2154項(xiàng)����,體外診斷試劑注冊申請1357項(xiàng)。
從注冊形式看��,首次注冊1055項(xiàng)��,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的30.0%�;延續(xù)注冊1777項(xiàng)��,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的50.6%����;許可事項(xiàng)變更679項(xiàng)����,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的19.3%。注冊形式分布情況見圖2����。
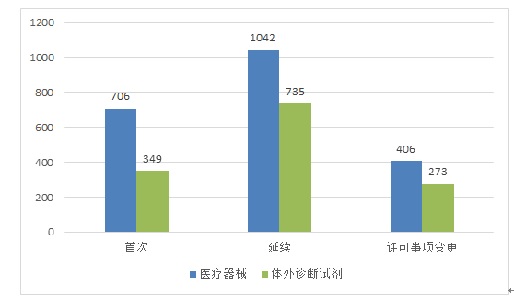
2.進(jìn)口第二類醫(yī)療器械注冊受理情況
進(jìn)口第二類醫(yī)療器械注冊受理共3053項(xiàng),與2018年相比增加43.7%����。其中醫(yī)療器械注冊申請1559項(xiàng),體外診斷試劑注冊申請1494項(xiàng)��。
從注冊形式看�,首次注冊358項(xiàng)�,占全部進(jìn)口第二類醫(yī)療器械注冊申請數(shù)量的11.7%;延續(xù)注冊1847項(xiàng)���,占全部進(jìn)口第二類醫(yī)療器械注冊申請數(shù)量的60.5%�;許可事項(xiàng)變更848項(xiàng),占全部進(jìn)口第二類醫(yī)療器械注冊申請數(shù)量的27.8%��。注冊形式分布情況見圖3�����。

3.進(jìn)口第三類醫(yī)療器械注冊受理情況
進(jìn)口第三類醫(yī)療器械注冊受理共2540項(xiàng)�,與2018年相比增加20.9%。其中醫(yī)療器械注冊申請2164項(xiàng)����,體外診斷試劑注冊申請376項(xiàng)。
從注冊形式看�,首次注冊280項(xiàng),占全部進(jìn)口第三類醫(yī)療器械注冊申請數(shù)量的11.0%�����;延續(xù)注冊1457項(xiàng)�,占全部進(jìn)口第三類醫(yī)療器械注冊申請數(shù)量的57.4%;許可事項(xiàng)變更803項(xiàng)��,占全部進(jìn)口第三類醫(yī)療器械注冊申請數(shù)量的31.6%����。注冊形式分布情況見圖4����。

三����、醫(yī)療器械注冊審批情況
2019年,國家藥監(jiān)局共批準(zhǔn)醫(yī)療器械首次注冊���、延續(xù)注冊和變更注冊8471項(xiàng)���,與2018年相比注冊批準(zhǔn)總數(shù)量增長53.2%。其中�����,首次注冊1726項(xiàng)��,延續(xù)注冊4504項(xiàng)��,許可事項(xiàng)變更2241項(xiàng)���。
2019年,企業(yè)自行撤回注冊申請210項(xiàng)�,自行注銷注冊證書66項(xiàng)�����。
近6年國家藥監(jiān)局批準(zhǔn)醫(yī)療器械注冊情況見圖5���。

(一)整體情況
2019年,國家藥監(jiān)局批準(zhǔn)境內(nèi)第三類醫(yī)療器械注冊3179項(xiàng)�����,與2018年相比增加86.0%��,進(jìn)口醫(yī)療器械5292項(xiàng)��,與2018年相比增加38.6%����。
按照注冊品種區(qū)分,醫(yī)療器械5226項(xiàng)�����,占全部醫(yī)療器械注冊數(shù)量的61.7%��;體外診斷試劑3245項(xiàng)��,占全部醫(yī)療器械注冊數(shù)量的38.3%。
按照注冊形式區(qū)分��,首次注冊1726項(xiàng)�,占全部醫(yī)療器械注冊數(shù)量的20.4%;延續(xù)注冊4504項(xiàng)�����,占全部醫(yī)療器械注冊數(shù)量的53.2%�����;許可事項(xiàng)變更注冊2241項(xiàng)���,占全部醫(yī)療器械注冊數(shù)量的26.4%��。注冊形式比例情況見圖6����?���!。ǘ┓猪?xiàng)情況
1.境內(nèi)第三類醫(yī)療器械注冊審批情況
境內(nèi)第三類醫(yī)療器械注冊3179項(xiàng)。其中����,醫(yī)療器械2014項(xiàng)�����,體外診斷試劑1165項(xiàng)���。
從注冊形式看�����,首次注冊1067項(xiàng)�����,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的33.6%��,延續(xù)注冊1465項(xiàng)���,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的46.1%;許可事項(xiàng)變更注冊647項(xiàng)�,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的20.4%。
2.進(jìn)口第二類醫(yī)療器械注冊審批情況
進(jìn)口第二類醫(yī)療器械注冊2754項(xiàng)。其中�,醫(yī)療器械注冊1521項(xiàng),體外診斷試劑注冊1233項(xiàng)�。
從注冊形式看,首次注冊375項(xiàng)����,占全部進(jìn)口第二類醫(yī)療器械注冊數(shù)量的13.6%;延續(xù)注冊1622項(xiàng)���,占全部進(jìn)口第二類醫(yī)療器械注冊數(shù)量的58.9%�;許可事項(xiàng)變更注冊757項(xiàng)����,占全部進(jìn)口第二類醫(yī)療器械注冊數(shù)量的27.5%。注冊形式分布情況見圖8����。
3.進(jìn)口第三類醫(yī)療器械注冊審批情況
進(jìn)口第三類醫(yī)療器械注冊2538項(xiàng)。其中�,醫(yī)療器械注冊2206項(xiàng),體外診斷試劑注冊332項(xiàng)���。
從注冊形式看�����,首次注冊284項(xiàng)�,占全部進(jìn)口第三類醫(yī)療器械注冊數(shù)量的11.2%;延續(xù)注冊1417項(xiàng)�,占全部進(jìn)口第三類醫(yī)療器械注冊數(shù)量的55.8%����;許可事項(xiàng)變更注冊837項(xiàng),占全部進(jìn)口第三類醫(yī)療器械注冊數(shù)量的33.0%�����。注冊形式分布情況見圖9��。
(三)首次注冊項(xiàng)目月度審批情況
2019年��,國家藥監(jiān)局共批準(zhǔn)醫(yī)療器械首次注冊1726項(xiàng)�,月度審批情況見圖10。
(四)具體批準(zhǔn)品種種類分析
注冊的境內(nèi)第三類醫(yī)療器械����,除體外診斷試劑外,共涉及《醫(yī)療器械分類目錄》中19個子目錄的產(chǎn)品���。
注冊數(shù)量前五位的境內(nèi)第三類醫(yī)療器械是:無源植入器械��、注輸����、護(hù)理和防護(hù)器械、神經(jīng)和心血管手術(shù)器械�����、醫(yī)用成像器械和有源手術(shù)器械�����。
注冊的進(jìn)口醫(yī)療器械�����,除體外診斷試劑外���,共涉及《醫(yī)療器械分類目錄》中23個子目錄的產(chǎn)品�。
注冊數(shù)量前五位的進(jìn)口醫(yī)療器械��,主要是:醫(yī)用成像器械�����、口腔科器械、無源植入器械�、臨床檢驗(yàn)器械、神經(jīng)和心血管手術(shù)器械����。
(五)進(jìn)口醫(yī)療器械國別情況
2019年,美國����、德國�����、日本���、韓國�、瑞士醫(yī)療器械在中國醫(yī)療器械進(jìn)口產(chǎn)品首次注冊數(shù)量排前5位����,注冊產(chǎn)品數(shù)量約占2019年進(jìn)口產(chǎn)品首次注冊總數(shù)量的75.4%,與2018年相比基本持平�����。
(六)境內(nèi)第三類醫(yī)療器械省份分析
從2019年境內(nèi)第三類醫(yī)療器械注冊情況看,相關(guān)注冊產(chǎn)品生產(chǎn)企業(yè)主要集中在沿海經(jīng)濟(jì)較發(fā)達(dá)省份�����。其中���,江蘇���、北京、廣東�、上海、浙江是境內(nèi)第三類醫(yī)療器械首次注冊數(shù)量排前五名的省份��,占2019年境內(nèi)第三類醫(yī)療器械首次注冊數(shù)量的69.1%����,與2018年相比略有增加。